:::
科技新知

腦病患者的新選擇-深腦刺激術
發表日期:2020-12-30
作者:楊璨伊(工研院)
摘要:
在目前臨床上,對於藥物已無法控制病情的帕金森氏症患者,多會建議以外科手術進行深腦刺激術(Deep Brain Stimulation, DBS),藉由電刺激來調節視丘下核(Subthlamic nucleus)的異常活性,控制不正常的腦神經訊號,成了另一種治療選擇。
全文:
一、前言
國發會在2020年8月18日公布最新的人口推估中指出,我國總人口數已於2020年2月便開始下滑,估計將從今年起進入「人口負成長時代」,相較原先推估的時間提早了兩年出現,而老年人口占比超過20%的超高齡社會也將提前一年於2025年到來。面對快速增加的老年人口,老化相關疾病患者也將快速增加,其中以阿茲海默症(Alzheimer’s disease)和帕金森氏症(Parkinson’s disease),為最常見的兩種神經退化性疾病,前者導致智力衰退,後者造成運動障礙問題。帕金森氏症是一種運動神經系統退化性疾病,患者常會出現顫抖、肢體僵硬、失去平衡感等動作障礙相關症狀,以現行的藥物治療往往到病程中後期會遇到瓶頸與副作用。在目前臨床上,對於藥物已無法控制病情的帕金森氏症患者,多會建議以外科手術進行深腦刺激術(Deep Brain Stimulation, DBS),藉由電刺激來調節視丘下核(Subthlamic nucleus)的異常活性,控制不正常的腦神經訊號,成了另一種治療選擇。
二、深腦刺激術
法國神經外科醫師Alim Louis Benabid在1987年首度於研究報告中指出,在視丘腹側VIM核區(Ventral intermedius nucleus)給予100 Hz的高頻電刺激,可以馬上抑制住帕金森氏症患者的顫抖症狀,而停止電刺激後症狀則重新出現,由其研究結果顯示高頻電刺激可以調控神經功能,並開啟了深腦刺激術的發展。1994年Benabid研究報告指出,在視丘下核給予130 Hz的高頻電刺激,可改善晚期帕金森氏症患者的動作困難(Akinesia)症狀。相關研究發展的十週年,美國食品藥物管理局(FDA)在1997年核准了Medtronic刺激視丘腹側VIM核區的深腦刺激器上市,以改善帕金森氏症與原發性顫抖症(Essential tremor)的頑固型顫抖症狀。2002年FDA進一步核准同樣由Medtronic開發之刺激視丘下核或內側蒼白球(Internal globus pallidus)的深腦刺激器上市,以改善帕金森氏症的運動障礙症狀。深腦刺激術的相關研究在2000年之後開始急速增加,其相關研究期刊數量也快速增長(圖1)。直到今日,深腦刺激術已成為主要治療帕金森氏症的神經外科手術,我國也在2015年1月1日與2019年8月1日分別將深腦刺激器和其所需導線之組件納入健保給付。
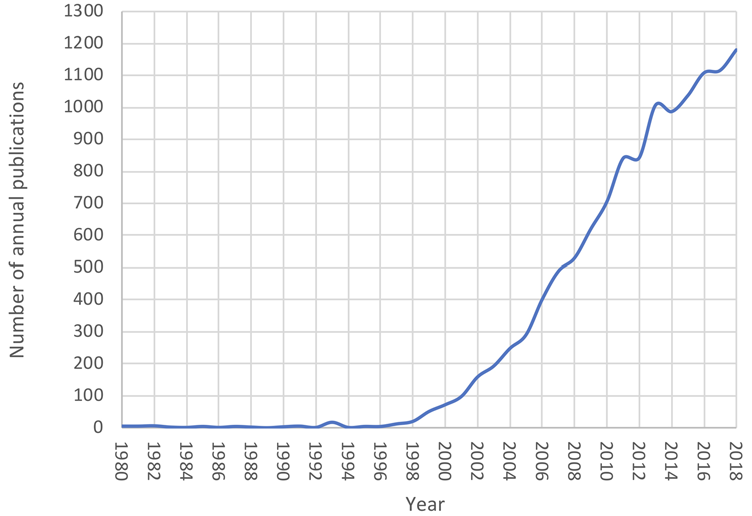
資料來源:Journal of Neurosurgery (2019)
圖1 1980年至2018年之間的深腦刺激術相關研究期刊數量
深腦刺激器的相關組件主要有三個部分,分別是植入深層腦部的電極(Lead)、植入胸前的刺激器(Implantable pulse generator),及連接此二者的延長導線(Extention)。其中刺激器的外型類似於人工的心臟節律調節器,主要功能為輸出適當參數的電刺激(圖2)。
隨著越來越多的研究學者與開發人員投入深腦刺激領域,全球相關產品市場也持續成長並擴張,其中前三大廠商分別是Medtronic、Boston Scientific和Abbott。
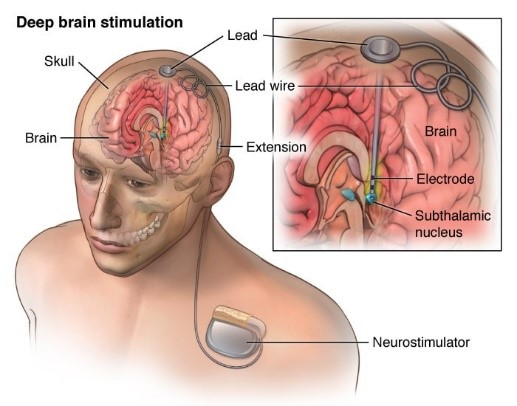
資料來源:American Association of Neurological Surgeons 官網
圖2 深腦刺激術裝置示意圖
1. Medtronic
Medtronic創立於1949年,公司總部位在愛爾蘭,過去投入研究與開發生物性電刺激的深腦刺激相關產品已有二十年以上經驗,1997年其產品即獲得美國FDA核准用於治療帕金森氏症患者。臨床上主要是透過外科手術方式,將腦部刺激器晶片植入到腦或胸部,透過電刺激將電脈衝送到腦中特定區域,以控制並調節腦內不正常的活動,對帕金森氏症、中風和癲癇等疾病進行治療。公司的新產品Percept PC Neurostimulator已於2020年1月獲得歐盟CE認證,並在同年6月獲得美國FDA認證。此產品特色為使用的BrainSense技術能夠長期感知與記錄大腦訊號,同時為帕金森氏症、原發性顫抖症、肌張力障礙(Dystonia)、癲癇和強迫症等相關的神經系統疾病患者提供治療。醫師可以將患者的特定大腦訊號,結合患者自行記錄的行為或經歷(例如症狀、副作用或藥物攝取等)進行關聯性分析,達到更加數據化與個人化的神經刺激治療。
2. Boston Scientific
Boston Scientific創立於1979年,公司總部位在美國,其開發針對治療帕金森氏症、原發性顫抖症、肌張力障礙患者之深腦刺激產品Vercise Gevia,已於2017年6月獲得歐盟CE認證,並在2019年8月獲得FDA認證。此產品特色為適用核磁共振造影(Magnetic Resonance Imaging, MRI),讓其裝置可以與Vercise Cartesia方向性電極,使用於磁場強度1.5 Tesla的全身MRI掃描儀中,使患者進行全身MRI掃描時,能同時接受深腦刺激裝置的治療。其裝置除了有方向性電刺激的特色之外,還配備了能使用約15年的充電電池(一般非充電電池壽命約4到5年)。在Vercise Gevia的相關臨床研究中,使用此系統治療了40名帕金森氏症患者,而試驗進行至第52週時,有63%的患者其運動能力和生活品質獲得改善。
3. Abbott
Abbott創立於1888年,公司總部位在美國,2017年1月併購了St. Jude Medical公司所開發的Infinity深腦刺激產品,已於2019年1月獲得歐盟CE認證,並在今年1月獲得FDA的核准,其產品之方向性標靶技術可適用帕金森氏症患者腦中與運動功能相關的內側蒼白球區位。除此之外,其產品也獲得批准透過刺激視丘下核和視丘腹側VIM核區,來治療帕金森氏症、原發性顫抖症與其他運動障礙相關疾病。Infinity系統具有藍牙連接功能,並與Apple iOS設備配合使用,使患者可以自行微調、打開或關閉深腦刺激器。此產品能向大腦標靶之位置傳遞輕度的電脈衝,藉以刺激運動障礙相關的腦區,同時也能抑制特定腦部訊號之異常反應。整體來說,此系統結合了無線軟體平台、患者舒適度優化,以及創新方向性電極技術等特色。
三、結論
深腦刺激術的發展已超過30年,深腦刺激器上市也有20幾年。然而,傳統的深腦刺激術(Conventional DBS)仍然有需改進之處。目前市面上的深腦刺激器是開放迴路系統(Open loop),當植入患者體內的刺激器開啟電源後,隨即提供腦內連續且不間斷的電刺激,直到電源耗盡才停止,一般植入約4到5年後患者就要再次進行手術以更換刺激器之電池。此外,傳統的連續電刺激方式也會引發一些副作用的產生,例如患者的步態不穩(Gait instability)、發音及言語障礙(Verbal fluency problem),或是電刺激所造成的異動症等(Stimulation-induced dyskinesia)。相關研究推論,可能是因為連續的電刺激不僅抑制了異常的神經功能,也影響到正常的神經功能運作。
近年來在個人化精準醫療(Precision medicine)量身訂做的趨勢下,能否設計出一種閉迴路系統(Closed-loop)的刺激器,透過偵測疾病獨特的生物特徵(Biomarker),作為電刺激回饋控制(Feedback control)的訊號,使其能根據輸出的生物特徵訊號調整電刺激,受到學者與醫師們的高度關注。目前各大相關醫材廠商持續的研發改良自身的產品,走向無線訊號傳輸、回饋控制、具無線充電等功能。臺灣交大和林口長庚的研究團隊也有持續性的合作計畫,採用台積電製程研發出的晶片,將理論與臨床結合,開發出「智慧型可適性閉迴路深腦刺激系統」,目前正在進行迷你豬的動物實驗以驗證安全性與功能性,預計2020年底申請人體臨床試驗。
參考資料:
1. Current and future directions of deep brain stimulation for neurological and psychiatric disorders. Darrin J. Lee et al. Journal of Neurosurgery (2019)
(本文作者為工研院產科國際所執行產業技術基磐研究與知識服務計畫產業分析師)
 點閱數
點閱數:
2055

