一、2021年美國FDA核准新藥的件數為歷年第三高,未因COVID-19疫情影響而大幅下滑
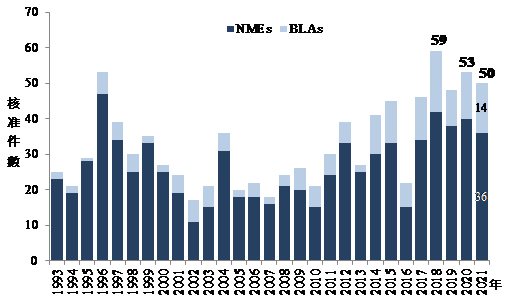
2021年美國FDA藥物評估暨研究中心(Center for Drug Evaluation and Research, CDER)核准之新藥件數高達50件,為自1993年以來第三高的件數,僅次於2018年的59件及2020年的53件,此外專門審查細胞治療、基因治療及疫苗等產品的生物製劑評估暨研究中心(Center for Biologics Evaluation and Research, CBER),在2021年所核准之件數亦有10件,顯示COVID-19疫情並未阻礙美國FDA核准新藥的速度(圖1)。
資料來源:Nature;DCB產資組ITIS研究團隊整理(2022.02)
圖1 1993~2021年美國FDA CDER核准之新藥件數
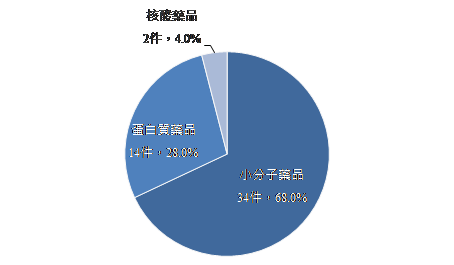
另分析核准的新藥類型,CDER核准之藥品以小分子藥品的占比最高,件數達34件,占CDER核准新藥件數的68%;蛋白質藥品則有14件,占比為28%;此外隨著核酸藥品在傳輸技術及包覆技術突破,再加上其療效及安全性被驗證,近幾年來,每年均有核酸藥品取得美國FDA的上市許可,2021年即有2件核酸藥品獲准上市(圖2)。另觀察CDER核准新藥之適應症布局情形,癌症仍為主要之適應症領域,約占三成;其次則為神經科學,約為一成;傳染性疾病及心血管疾病則均有4件產品獲准上市,占比為8%,位居第三。
資料來源:美國FDA;DCB產資組ITIS研究團隊整理(2022.02)
圖2 2021年美國FDA核准之新藥藥品類型占比
CBER在2021年亦批准多項生物製劑,包括疫苗、嵌合抗原受體T細胞(Chimeric Antigen Receptor T cell, CAR-T細胞)療法及組織再生等產品。觀察CBER核准之產品類型,以疫苗產品件數最多,達5件,而用於預防COVID-19的mRNA疫苗亦在其中;另CAR-T細胞療法及組織再生則各有2件產品獲得CBER核准上市。
2021年美國FDA核准的新藥中,有多項具里程碑意義的產品獲准上市,包括第一個治療阿茲海默症的抗體藥品Aduhelm(aducanumab)、預防COVID-19的mRNA疫苗Comirnaty(tozinameran)、第一個KRASG12C抑製劑Lumakras(sotorasib)、以及第一個針對B細胞成熟抗原(B-Cell Maturation Antigen, BCMA)的CAR-T細胞治療產品Abecma(idecabtagene vicleucel)等,以下分別介紹。
二、第一個號稱可緩解阿茲海默症病程發展之藥品,成為2021年最具爭議的產品-Aduhelm
在Aduhelm之前,阿茲海默症的治療藥品主要使用乙醯膽鹼酶抑制劑(acetylcholinesterase inhibitor)及NMDA受體拮抗劑(NMDA receptor antagonist)兩大類,其中乙醯膽鹼酶抑制劑可抑制腦中乙醯膽鹼酶,減緩症狀的惡化,而NMDA受體拮抗劑則是可降低麩胺酸對腦細胞形成的破壞,兩者均屬於症狀治療,而無法減緩病程的發展,更遑論治癒。
Aduhelm為Biogen所開發的阿茲海默症抗體藥品,患者在用藥後,可觀察到腦中因β型類澱粉蛋白(β-amyloid protein, Aβ蛋白)聚集而產生的蛋白斑塊減少累積,藉由這樣的結果期待可以延緩病情的發展,進而達到治療疾病的目的。但該項藥品的開發過程相當戲劇性,2019年3月因未能在Aduhelm的兩個臨床III期試驗期中結果找出患者認知改善的療效證據,因此宣布暫停開發。而同年10月Biogen改變其評估方式,重新分析數據後,發現在臨床III期試驗中,Aduhelm可抑制Aβ蛋白的累積,其中高劑量組別更可抑制59~71%的Aβ蛋白斑塊生成,因此Biogen再次向美國FDA提交審查申請。2020年美國FDA委託成立的獨立專家小組則因無法確認Aduhelm之療效,質疑觀察Aβ蛋白斑塊累積的臨床意義而反對核准,而FDA仍根據患者腦中的斑塊消失,在2021年6月加速批准(accelerated approval)上市,使得Aduhelm成為2021年最具爭議的產品。
雖然Aduhelm在美國順利上市,但美國FDA要求Biogen後續應進行確認性試驗,以確定其療效,如最後為負面結果,美國FDA將可能取消其加速批准。此外Aduhelm在歐洲仍有一段路要走,2021年12月歐洲藥品管理局(European Medicines Agency, EMA)因Biogen所提供的臨床資料雖顯示可減少Aβ蛋白斑塊累積,但未有明顯的臨床效果,且雖然高劑量組可更有效的抑制Aβ蛋白斑塊累積,但是可能造成使用者腦部異常腫脹或出血的副作用,因此予以駁回。
而除了取證在美國以外的地區受挫之外,Aduhelm在銷售方面亦面臨極大的挑戰,以受到質疑的數據取證,且依開始的訂價訂為56,000美元,在引發大眾強烈的不滿之後,Biogen調降售價至28,200美元,在種種因素影響下,使Aduhelm在2021年僅貢獻Biogen營收300萬元,雖Aduhelm取得CMS的醫療保險,但因其覆蓋範圍僅限於被核准的臨床試驗中的患者,預估在2022年對於Biogen的營收貢獻不樂觀。在後續臨床試驗持續進行造成龐大的支持,及市場銷售預期不佳的情形之下,拖累被學名藥及其他競爭者分蝕Biogen營運表現,未來如何規劃Aduhelm的銷售策略及其臨床驗證結果都將影響Biogen的發展。
三、技術逐漸成熟及環境急迫的需求,推動mRNA疫苗快速上市-Comirnaty
2020~2021年無疑是mRNA疫苗最風光的年代,受到COVID-19疫情的影響,全球經濟陷入癱瘓,民眾的健康也受到嚴重威脅,為加速預防性產品的開發及上市,mRNA疫苗因其開發原理及流程,使其開發時間相較於過往的蛋白質疫苗快速,從獲得病毒序列之後,最快可在六個星期後產生候選疫苗進入臨床試驗,對於突發的或病毒變異速度快的流行性疾病而言,可以有效解決迫切需要預防性疫苗的問題。
2020年1月BioNTech即投入COVID-19的mRNA疫苗Comirnaty開發,同年3月Pfizer亦與其合作,5月進行臨床I/II期試驗,7月更是開始臨床II/III期試驗,期間滾動式將相關試驗數據提交給法規單位,雖然臨床II/III期試驗在當時尚未完成,但相關數據證明其安全性及有效性,因此在2020年12月美國FDA即核准緊急使用授權,後續持續BioNTech及Pfizer更是持續進行臨床試驗,在2021年8月取得正式的全面許可(full approval)。Comirnaty的整體開發時間耗時1.5年,相較於過往疫苗的開發時間10.7年,明顯縮短,除歸功於mRNA的候選疫苗開發時間快之外,法規單位積極配合產品驗證,並在可接受的情況下簡化臨床試驗的程序,亦為Comirnaty可這麼快取得上市許可的重要推動力。
自2012年開始,Pfizer有多項暢銷藥品在各主要市場陸續到期,使Pfizer的營收受到壓力,為弭補營收成長的缺口,Pfizer積極尋找新機制藥品或創新療法以增加產品線及公司競爭力。2015年Pfizer即開始布局mRNA技術,並於2018年與BioNTech合作開發mRNA流感疫苗,至2020年年初全球爆發COVID-19疫情,再次與BioNTech合作開發mRNA COVID-19疫苗Comirnaty。而Comirnaty除了在疫苗上市速度創下紀錄之外,其銷售成果對於開發廠商的營收貢獻亦不容小覷,根據Pfizer在2022年2月公布的第4季財報顯示,2021年Pfizer全年營收為813億美元,其中單Comirnaty的銷售金額高達368億美元,占Pfizer營收的45%,而這樣的結果除了因龐大的市場需求之外,亦受惠於Pfizer長期布局mRNA疫苗的結果,使Pfizer可在疫情初期即投入疫苗產品的開發。
Comirnaty讓Pfizer對於mRNA技術更具信心,2021年年底及2022年年初即與多家核酸技術平台公司簽約,如與Codex DNA合作,取得合成DNA技術,加速mRNA疫苗開發;與基因編輯技術公司BEAM合作,取得鹼基基因編輯技術,用於開發罕見遺傳疾病的療法;取得Acuitas⾮專屬授權LNP技術,包覆mRNA,使其更加穩定。在嘗到mRNA技術所帶來的甜頭之後,未來Pfizer仍將持續應用mRNA技術於疫苗開發,擴大疫苗產品線,亦將探尋mRNA技術未來具可能性的發展。
四、新藥物開發平台克服無法成藥之治療標的-Lumakras
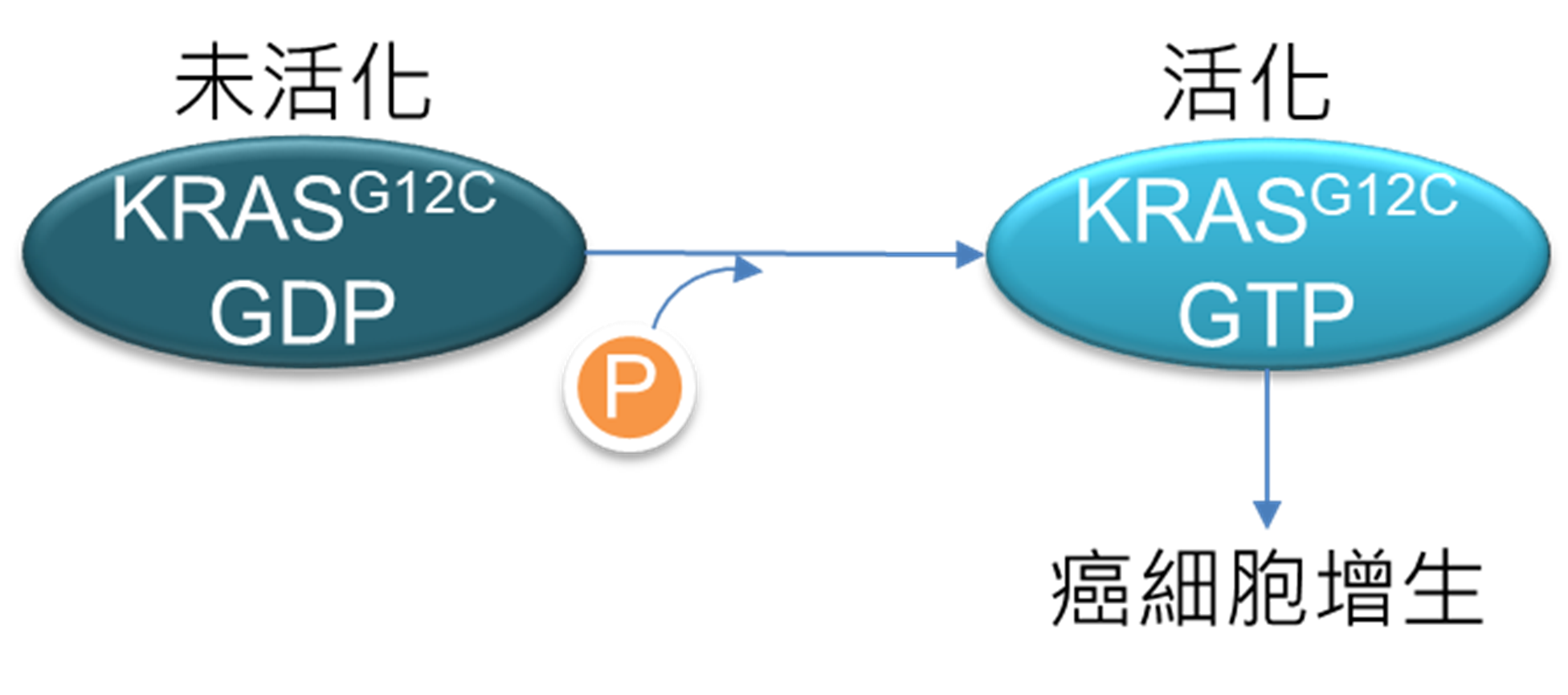
Amgen所開發之Lumakras於2021年5月獲美國FDA上市許可,其適應症為治療KRASG12C突變的晚期局部或轉移性非小細胞肺癌的二線用藥。自40多年前,KRAS被發現為原致癌基因(proto-oncogene)後,越來越多的研究顯示許多癌症患者有KRAS突變,其中非小細胞肺癌患者約有1/4帶有KRAS突變,大腸癌約三成,另胰臟癌患者則約有六成。KRAS突變將造成持續活化,並將訊息傳遞至下游,使抑制細胞凋亡的機制被開啟,讓細胞異常增生,進而形成腫瘤,因此成為癌症治療的重要靶點(圖3)。
資料來源:DCB產資組ITIS研究團隊(2022.02)
圖3 KRASG12C致癌簡圖
但是KRAS蛋白質的表面結構平滑,缺乏抗原表位,另KRAS-GTP具高结合常数(association constant, Ka),一般小分子藥品難與之競爭使KRAS回復至為活化狀態,因此使得這個靶點成為難以成藥的蛋白(undruggable protien),不易開發藥品進行治療。而因KRAS不易成藥,新興藥品開發策略或機制成為,例如PROTACs、外泌體(exosomes)等,被應用於開發KRAS標靶藥品,但目前仍在研發階段。
Lumakras則是反其道而行,未與活化的KRASG12C競爭GTP的結合位點,反而針對未活化KRASG12C之小分子標靶藥品,在與未活化KRASG12C結合後,抑制其活化,進而中止癌細胞增生之訊息傳導路徑。Lumakras之所以能夠攻克不易成藥的KRAS這座大山,在於Amgen與Carmot合作,利用Carmot的基於片段的藥物設計方法(Fragment-Based Drug Design, FBDD)尋找KRASG12C候選藥物,以片段結構資料庫篩選可鍵結於作用標的之片段,再將數個片段組合並優化。在Lumakras治療124名KRASG12C非小細胞肺癌患者的臨床試驗中,其客觀緩解率有36%,疾病控制率達81%,另反應持續時間中位數達10個月,其研究的結果使美國FDA加速批准Lumakras,從進入臨床試驗至取得上市許可,僅花了3年不到的時間即完成。
目前Lumakras所布局的適應症除了非小細胞肺癌之外,亦進行大腸癌及胰腺癌的臨床試驗。在2022年2月的ASCO會議中,Amgen發表Lumakras治療KRASG12C晚期胰腺癌的結果具臨床意義,其客觀反應率為21%,疾病緩解率達到84%,中位存活期為6.9個月,對於五年生存率僅10%的胰腺癌患者而言不啻為福音。而靶向不易成藥的靶點及持續擴充的適應症也讓Lumakras未來的銷售看漲,自2021年5月Lumakras取得美國上市許可之後,其在2021年的銷售總額達到9,000萬美元,而根據Globaldata的資料顯示,預估2025年Lumakras的銷售額將達12.1億美元,可望邁入暢銷藥物之列。
五、CAR-T細胞療法擴展適應症領域至多發性骨髓瘤-Abecma
為了突破暢銷藥物專利到期的困境,Bristol Myers Squibb(BMS)積極布局新興生物藥品,將資源重新分配,2018年併購細胞治療廠商Juno,取得CAR-T細胞治療技術。2020年BMS第一個CAR-T細胞治療產品Breyanzi取得美國FDA上市許可,該項產品標靶於CD19,取得之適應症為瀰漫性大B細胞淋巴瘤的二線治療。
2021年3月BMS與Bluebird合作開發的CAR-T細胞療法產品Abecma,成為BMS第二個通過美國FDA審查的CAR-T細胞治療產品,該項產品標靶於BCMA,用於治療4線以上復發或難治型多發性骨髓瘤成年患者。Abecma為第1個針對BCMA之CAR-T細胞療法,先前的4個產品則都是針對CD19,而這個產品上市後,也讓BMS成為第一個也是唯一一個擁有2個靶點不同的CAR-T細胞治療產品,此外,新的腫瘤抗原標的,也使得CAR-T細胞療法可望擴充適應症,增加治療領域。
Abecma上市後,因為首個多發性骨髓瘤的CAR-T細胞療法產品,但無其他同類型的競爭者,且對於多發性骨髓瘤的治療效果佳,因此銷售表現相當亮眼。根據其臨床試驗結果,總體緩解率達72%,28%的患者達到完全緩解;此外,65%患者的緩解持續至少12個月,其治療明顯優於現有標準療法,因此雖然價格昂貴,但市場需求仍高。
2021年3月獲准上市,並於5月正式於市面銷售,其在2021年的銷售額達1.64億美元。但Abecma出貨發生供不應求的狀況,除了因為市場需求大大超過產能之外,病毒載體的短缺也是影響產量的重要因素。為解決Abecma供應短缺的問題,BMS積極與委託研究開發暨生產服務(Contract Development and Manufacturing Organization, CDMO)廠商合作,協助快速生產病毒載體,同時培訓員工以提升CAR-T細胞治療產品的產量及工作效率。由Abecma的例子可以看到新興療法除了產品的療效確認之外,後續的供應亦相當重要,而為了確保產品足夠滿足市場需求,國際大廠透過委外代工取得病毒載體,並以內部自建提高CAR-T細胞治療產品生產效率的方式,建構其供應鏈。
六、結論
回顧2021年美國FDA審查取得上市取可的產品,其件數未明顯下滑,並由癌症藥品領軍,核准件數最多,另根據CDER的資料顯示,2021年核准的50件產品中,有27件產品(54%)為First-in-Class產品,新開發方式如FBDD或新興藥物類型如核酸藥品,推動這些新獨特作用機制的產品上市。
自2020年COVID-19疫情大流行後,對於美國FDA的新藥審查工作帶來重大的挑戰,而因為無法進行實地審查,根據Endpoints News的資料顯示,在COVID-19疫情爆發之前,監管單位每年約1,000次的國外藥品檢查,而從2021年4~9月僅進行37項外國藥品檢查,根據2021年11月美國FDA所公布的報告顯示有55件產品在審查階段被延誤,使得少數產品無法在2021年獲得上市許可。然而為降低相關案件的積壓,自2021年7月之後,美國FDA開始啟動檢查其國內的生產設施工作,為使審查工作能持續,美國FDA除要求工廠提供相關生產文件使審查人員可在廠外進行檢查之外,亦運用遠距工具如視訊訪視、審查等進行藥品的監管,維持穩定的審查步伐並核准新藥上市。
雖然面臨審查上的重大挑戰,但是受到新興技術漸趨成熟及市場需求的迫切性影響,2021年美國FDA仍通過多件具里程碑意義的產品的上市申請,如不易成藥的靶點-KRAS抑制劑、COVID-19的mRNA疫苗及阿茲海默症抗體藥品等,而在安全性及有效性提升的前提下,美國FDA勇於嘗試創新的作用標靶及新興藥品類型,期待能滿足疾病治療的需求,增加病患的福祉。
為了減少上市產品專利到期對公司營收的影響,或尋找競爭者較少、發展機會較多的市場,藥廠積極布局新作用標的或新藥品類型。而從2021年被美國FDA核准的新藥可以看到,越來越多新作用標的或新藥品類型上市。另觀察這些新藥上市後的情形可以發現,新藥的開發除了產品療效確認之外,後續的訂價策略、生產供應等亦須及早進行考慮及規劃,避免在產品取得上市許可後,與Biogen及BMS一樣分別面臨定價爭議及供貨不及的狀況,影響公司銷售表現。國內亦有多家新藥開發廠商,布局新作用標的或新藥品類型,借鏡這些上市藥品及其上市後之情形,擬定產品的定位、方向及商業化策略,有助於降低發展的阻力,使新藥開發及商業化的路程更加順利。
(本文作者為生技中心執行產業技術基磐研究與知識服務計畫產業分析師)