:::
科技新知

基因治療產品發展現況與趨勢
發表日期:2025-02-05
作者:寇怡衡(生技中心)
摘要:
2017年美國FDA核准第1個病毒載體基因治療、首2項CAR-T療法;2023~2024年核准第1個基因編輯療法及第1個TCR-T細胞療法,讓基因治療的發展達成重要里程碑,目前全球已核准32項基因治療上市。
全文:
2017年美國FDA核准第1個病毒載體基因治療、首2項CAR-T療法;2023~2024年核准第1個基因編輯療法及第1個TCR-T細胞療法,讓基因治療的發展達成重要里程碑,目前全球已核准32項基因治療上市。本報告整理基因治療發展現況,並介紹類似作用機制的療法(CAR-T療法及TCR-T療法),以及相同應用但不同機制的療法(Casgevy及Lyfgenia基因編輯HSC),最後說明基因治療的挑戰。
一、基因治療定義及產品範疇
基因治療態型多元,各國對於基因治療的定義及範疇亦略有差異,全球主要醫藥市場對於基因治療的定義可參考醫藥產業年鑑的整理1 。綜合來說,基因治療是指修改人類基因以治療疾病的技術,本報告所涵蓋之各類型產品定義說明如表1。
基因治療依基因修飾或基因編輯是否發生在人體內,大致可分為體內(in vivo)和離體(ex vivo)基因治療。In vivo是將治療疾病的基因直接遞送至病人體內,基因本身即是治療藥物,例如病毒載體基因治療;ex vivo則是將病人的細胞先在體外進行基因修改後再輸送回體內,是透過基因修飾而產生治療藥物,例如CAR-T療法。
基因治療可以透過不同的遞送方式,例如病毒載體、非病毒載體、物理性遞送(如電穿孔(electroporation))等。病毒載體因為具有較佳的基因遞送能力,被廣泛用於基因治療,約占90%。其中腺相關病毒(Adeno-Associated Virus, AAV)因為嵌入病人基因體的機率低,且具有低免疫源性,被普遍使用於in vivo的病毒載體基因治療,約占49%。其次為慢病毒(lentivirus, LV)載體,約占23%,因為LV易於基因體融合(integration)的特性,有利於ex vivo進行細胞的基因修飾,所以CAR-T療法多使用LV載體,透過病毒載體將CAR基因送到T細胞,約占產品數量的65%,其次為反轉錄病毒載體,兩者合計占CAR-T療法產品數量的8成。
表1 基因治療類型
| 機制 |
主要產品類型 |
說明 |
| 基因傳送(gene delivery) |
病毒載體基因治療 |
利用病毒載體遞送正常基因給病人,以治療疾病 |
| 溶瘤病毒(OV) |
利用基因工程讓病毒攜帶可表現免疫刺激因子的基因,使其感染並溶解腫瘤細胞 |
| 基因修飾(gene modification) |
基因修飾造血幹細胞(HSC) |
利用基因工程將表現特定蛋白質的基因植入造血幹細胞 |
| 嵌合抗原受體T細胞(CAR-T)療法 |
利用基因工程將可專一性辨識癌症細胞的CAR基因植入T細胞 |
| T細胞受體T細胞(TCR-T)療法 |
改良T細胞之TCR以增強其辨識特定抗原的能力 |
| 基因編輯(gene editing) |
CRISPR療法 |
將基因編輯分子遞送至人體,於體內修改特定基因 |
註:OV:Oncolytic Virus;HSC:Hematopoietic Stem Cells;CAR-T:Chimeric Antigen Receptor T cell;TCR-T:T Cell Receptor T cell;CRISPR:Clustered Regularly Interspaced Short Palindromic Repeats,常間回文重複序列叢集
資料來源:生技中心整理(2025/01)
二、基因治療發展現況
2017年是基因治療發展一個重要的里程碑,美國FDA核准了第1個AAV載體基因治療Luxturna,以及首2個CAR-T療法Kymriah、Yescarta;2023年及2024年,美國FDA又相繼核准了第1個基因編輯療法Casgevy及第1個TCR-T療法Tecelra,基因治療的發展再向前邁進一步。隨著基因工程、基因編輯等技術越來越成熟,基因治療型態也更加多元,至2024年12月,全球共核准32項基因治療(表2),包括病毒載體基因治療10項、溶瘤病毒3項、基因修飾造血幹細胞5項、CAR-T療法12項、TCR-T療法1項及CRISPR療法1項。根據Citeline公司的統計,目前開發中的基因治療產品超過2,000項,其中超過半數為基因修飾細胞療法(包括基因修飾造血幹細胞(HSC)、CAR-T療法、TCR-T療法等),約占基因治療產品數的55%;其次為基因傳送型態的基因治療,約占35%;基因編輯療法數量則較少,只占約10%。
表2 核准上市的基因治療產品
| 產品名 |
開發公司 |
最早核准年份 |
標靶 |
基因遞送方式 |
| 病毒載體基因治療 |
| Glybera |
UniQure |
2013年 |
脂蛋白脂酶(LPL) |
病毒載體(AAV) |
| Luxturna |
Spark Therapeutics |
2017年 |
RPE65 |
病毒載體(AAV) |
| Zolgensma |
Novartis |
2019年 |
SMN |
病毒載體(AAV) |
| Hemgenix |
CSL Behring |
2022年 |
第9凝血因子 |
病毒載體(AAV) |
| Adstiladrin |
Ferring |
2022年 |
干擾素α2b受體 |
病毒載體(腺病毒) |
| Roctavian |
BioMarin |
2023年 |
第8凝血因子 |
病毒載體(AAV) |
| Elevidys |
Sarepta Therapeutics |
2023年 |
肌失養蛋白(Dystrophin) |
病毒載體(AAV) |
| Vyjuvek |
Krystal Biotech |
2023年 |
7型膠原蛋白 |
病毒載體(HSV) |
| Beqvez |
Pfizer |
2024年 |
第9凝血因子 |
病毒載體(AAV) |
| Kebilidi |
PTC Therapeutics |
2024年 |
芳香族L-胺基酸脫羧酶(AADC) |
病毒載體(AAV) |
| 溶瘤病毒 |
| Oncorine |
Shanghai Pharmaceuticals |
2005年 |
顆粒球-巨噬細胞集落刺激因子(GM-CSF) |
病毒載體(腺病毒) |
| Imlygic |
Amgen |
2015年 |
GM-CSF |
病毒載體(HSV) |
| Delytact |
Daiichi Sankyo |
2021年 |
GM-CSF |
病毒載體(HSV) |
| 基因修飾HSC |
| Strimvelis |
GSK |
2016年 |
腺苷脫氨酶(ADA) |
病毒載體(RV) |
| Zynteglo |
Bluebird Bio |
2019年 |
β血紅蛋白 |
病毒載體(LV) |
| Libmeldy |
Orchard Therapeutics |
2020年 |
ARSA |
病毒載體(LV) |
| Skysona |
Bluebird Bio |
2021年 |
ABCD1 |
病毒載體(LV) |
| Lyfgenia |
Bluebird Bio |
2023年 |
β血紅蛋白 |
病毒載體(LV) |
| CAR-T療法 |
| Kymriah |
Novartis |
2017年 |
CD19 |
病毒載體(LV) |
| Yescarta |
Gilead/ Kite |
2017年 |
CD19 |
病毒載體(RV) |
| Tecartus |
Gilead/ Kite |
2020年 |
CD19 |
病毒載體(RV) |
| Breyanzi |
BMS/ Juno |
2021年 |
CD19 |
病毒載體(LV) |
| Abecma |
BMS/ Bluebird |
2021年 |
BCMA |
病毒載體(LV) |
| Carteyva |
JW Therapeutics |
2021年 |
CD19 |
病毒載體(LV) |
| Carvykti |
J&J/ Legend Bio |
2022年 |
BCMA |
病毒載體(LV) |
| Fucaso |
Nanjing IASO Biotechnology |
2023年 |
BCMA |
病毒載體(LV) |
| Yuanruida |
Juventas Cell Therapy |
2023年 |
CD19 |
病毒載體 |
| NexCar19 |
ImmunoACT |
2023年 |
CD19 |
病毒載體(LV) |
| Aucatzyl |
Autolus |
2024年 |
CD19 |
病毒載體(LV) |
| Xikaize |
CARsgen Therapeutics |
2024年 |
BCMA |
病毒載體(LV) |
| TCR-T療法 |
| Tecelra |
Adaptimmune |
2024年 |
MAGE-A4 |
病毒載體(LV) |
| CRISPR療法 |
| Casgevy |
Vertex、CRISPR Therapeutics |
2023年 |
BCL11A |
電穿孔 |
註:LPL:Lipoprotein Lipase;RPE65:Retinal Pigment Epithelium-specific 65 kDa Protein;SMN:Survival Motor Neuron,運動神經元存活蛋白;AADC:Aromatic L-aminoacid Decarboxylase;GM-CSF:Granulocyte-Macrophage Colony-Stimulating Factor;ADA:Adenosine Deaminase;ARSA:Arylsulfatase A,芳基硫酸酯酶A;ABCD1:ATP Binding Cassette Sub Family D Member 1;BCMA:B Cell Maturation Antigen,B細胞成熟抗原;MAGE-A4:Melanoma-Associated Antigen 4,黑色素瘤相關抗原4;BCL11A:B-Cell Lymphoma/leukemia 11A,B細胞淋巴癌/白血病11A;HSV:Herpes Simplex Virus,單純疱疹病毒;RV:Retrovirus,反轉錄病毒
資料來源:GlobalData;生技中心整理(2025/01)
各類型基因治療因作用機制不同,各有其應用優勢。病毒載體基因治療可傳送正常基因至體內,適合應用於基因缺陷造成的遺傳性疾病;例如Elevidys利用AAV載體遞送肌失養蛋白的正常基因至病人體內,用於治療裘馨氏肌肉失養症(Duchenne Muscular Dystrophy, DMD)2 。基因編輯療法可直接將異常的基因序列替換為正常的序列,適合用於基因突變造成的遺傳性疾病;例如CRISPR療法Casgevy直接編輯BCL11A基因的序列,恢復胎兒血紅蛋白的生產,用以治療鐮刀型紅血球疾病(Sickle Cell Disease, SCD)。而CAR-T療法或TCR-T療法,主要是加強T細胞辨識及毒殺腫瘤細胞的能力,適應症以癌症為主;例如全球首例CAR-T療法Kymriah,便是利用LV載體遞送CD19受體的基因至T細胞,在T細胞表面表現CD19受體,讓病人自己的T細胞可以辨識過度表達CD19的B細胞癌。
進一步分析基因治療的應用領域,根據Citeline於2024年10月發表的報告3 ,開發中基因治療應用於癌症和罕見疾病的數量,分別占所有基因治療數量的33.4%和31.9%。若只分析臨床試驗階段的產品,則應用於罕見疾病的略多於癌症,占比分別為36.9%(癌症)和40%(罕見疾病)。而基因治療於罕見疾病的適應症中,有53%為癌症,數量前5名依序為骨髓瘤、急性骨髓性白血病(Acute Myelogenous Leukemia, AML)、非霍奇金氏淋巴瘤(Non-Hodgkin Lymphoma, NHL)、B細胞淋巴癌(B cell lymphoma)及卵巢癌。
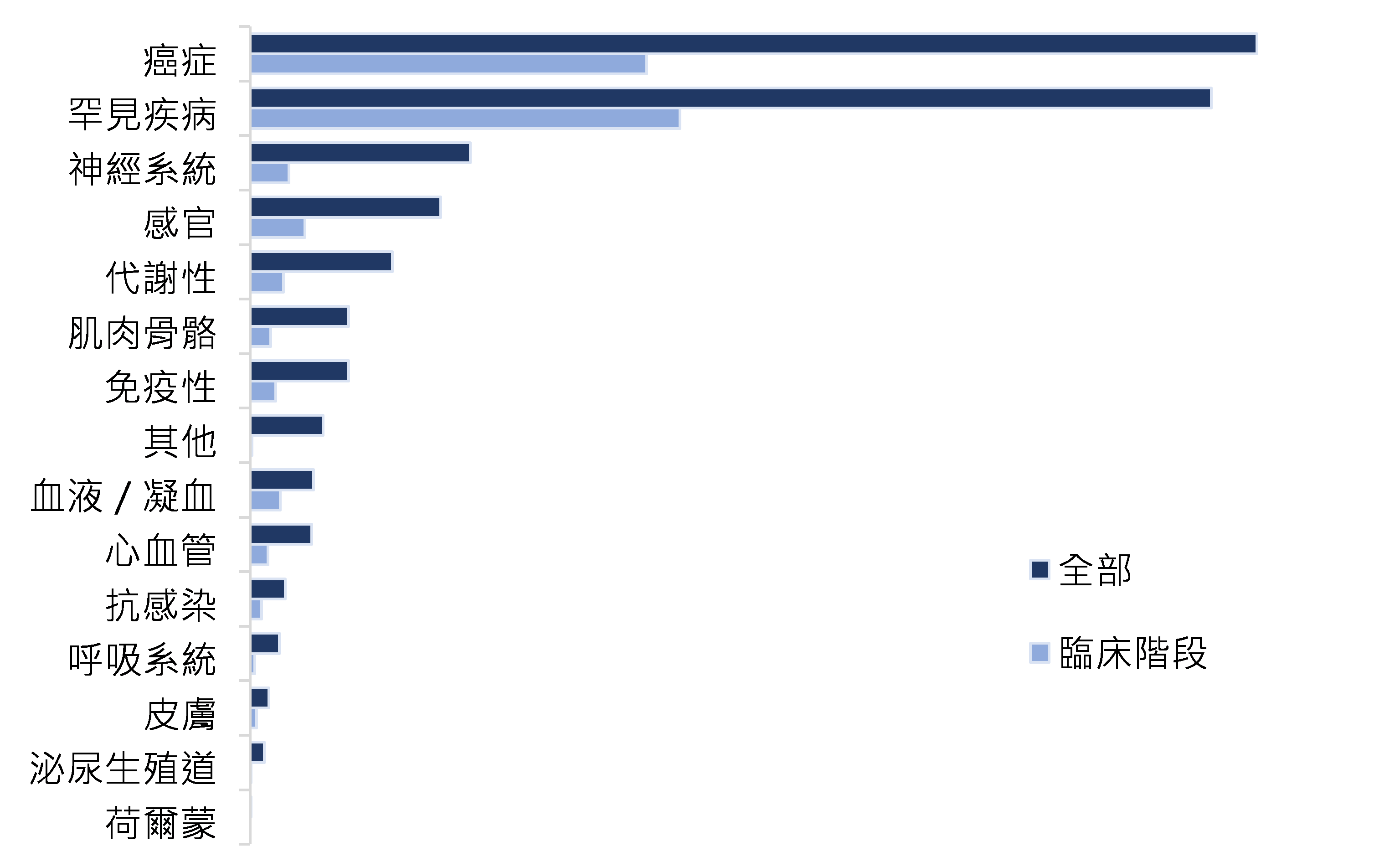
資料來源:ASGCT and Citeline, 2024;生技中心整理(2025/01)
圖1 各類型基因修飾細胞療法數量占比
三、基因修飾細胞治療以CAR-T為主力、TCR-T具應用潛力
於GlobalData資料庫查詢基因修飾細胞療法,以CAR-T為最多數,占所有基因修飾細胞療法的56%,其次為TCR-T占12%、CAR-NK(嵌合抗原受體自然殺手細胞)占6%,其他則包括TCR-NK、CAR-M(嵌合抗原受體巨噬細胞)、HSC等,共占26%(圖2)。
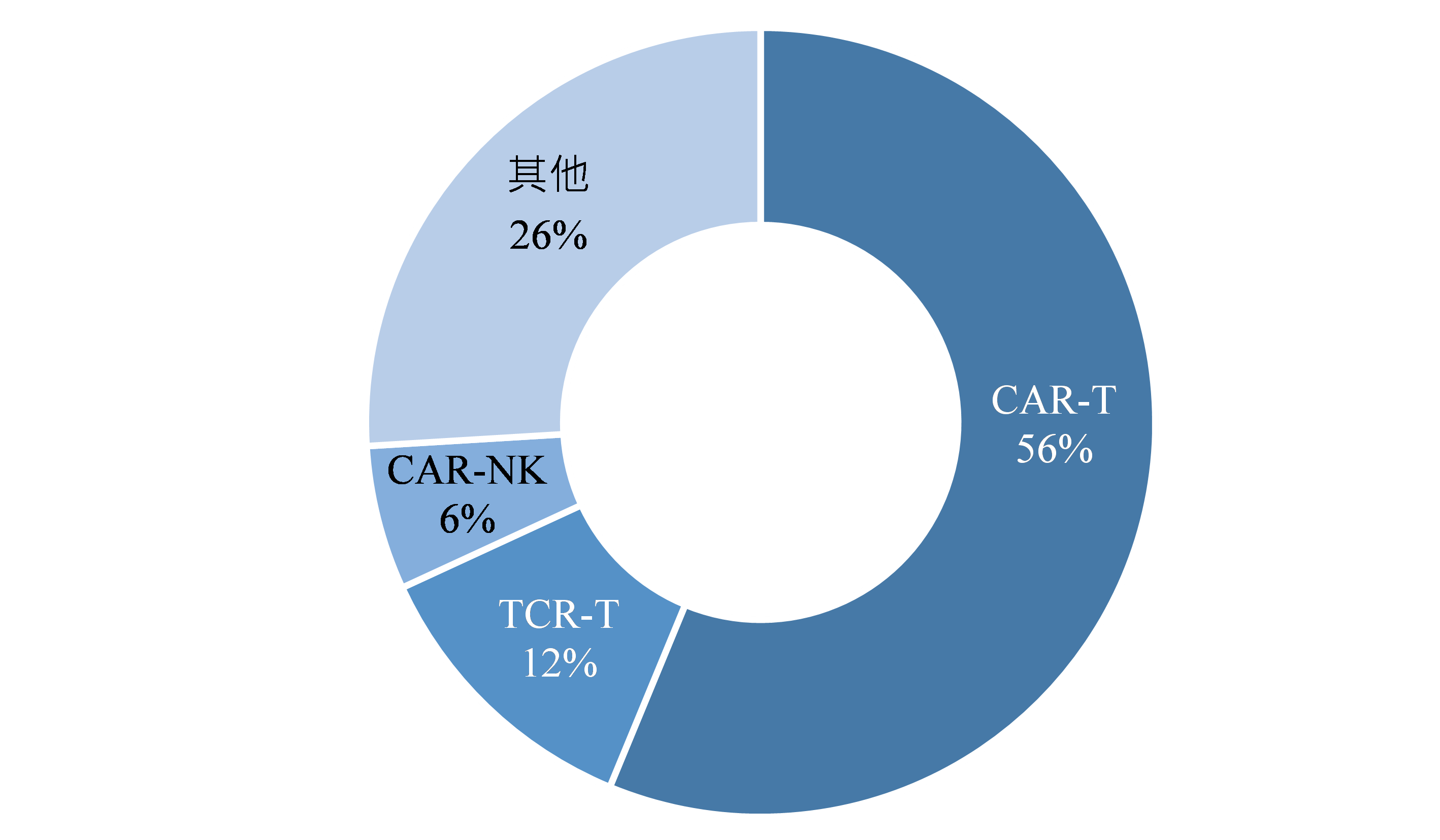
資料來源:GlobalData;生技中心整理(2025/01)
圖2 各類型基因修飾細胞療法數量占比
目前已核准的12項CAR-T療法適應症都是血液腫瘤,作用標靶分別為CD19(8項產品)和BCMA(4項產品)。觀察目前在開發中的CAR-T療法,CD19單一標靶或CD19合併其他標靶的CAR-T療法數量,約占所有開發中CAR-T療法數量的21%。標靶數量次多的是BCMA,單一或合併標靶的數量約為8%。而針對實體腫瘤的CAR-T療法標靶,如B7-H3、Claudin 18、Mesothelin等,進展最快的在臨床II期試驗階段,可見CAR-T療法於實體腫瘤的應用仍是目前極大的挑戰。
分析開發中的TCR-T療法,除了1項產品已核准上市,進展最快的在臨床II期試驗階段,但相較於CAR-T療法,標靶明顯更加多元。目前在臨床II期階段的TCR-T療法產品,作用標靶包括NY-ESO-1、KRAS、MART-1等,適應症均為實體腫瘤。
四、技術突破開創基因治療新領域
1. TCR-T開啟實體腫瘤治療新篇章
CAR-T療法是從病人體內抽取出T細胞後,利用基因工程讓這些T細胞表現特定的抗原受體,再將修飾過的T細胞擴增後注回病人體內,使其藉由CAR辨識表現特定腫瘤抗原的癌細胞,進一步毒殺癌細胞。
CAR-T療法的成功,始於2012年第一位接受CAR-T療法的小女孩Emily Whitehead,她於6歲時急性淋巴性白血病復發,化療無效後接受CAR-T療法,至今已連續11年體內沒有癌細胞。Emily Whitehead的治療成功讓各界驚豔,CAR-T療法成為劃時代的突破,2017年,美國FDA核准全球首2項CAR-T療法上市,至2024年已核准了12項CAR-T療法。然而,CAR-T療法常伴有嚴重副作用,例如大量細胞因子釋放造成的細胞激素風暴(cytokine storm)、CAR-T細胞攻擊正常細胞引發的脫靶效應(off-target effect)等,此外,CAR-T療法可能會產生繼發性T細胞腫瘤,因此FDA在2024年1月對6款FDA核准上市的CAR-T療法(Kymriah、Yescarta、Tecartus、Breyanzi、Abecma、Carvykti)發出黑框警告(Black Box Warning),警示CAR-T療法誘發二次血癌的風險,並且建議接受治療的患者必需終生監測。
2024年8月,美國FDA核准Adaptimmune Therapeutics公司的Tecelra上市,是全球第一款TCR-T療法,用於治療晚期滑膜肉瘤(Synovial sarcoma)這種罕見的實體腫瘤。Tecelra是第一個治療實體腫瘤的基因修飾T細胞療法,也是首個針對滑膜肉瘤的治療選擇。TCR-T療法是收集患者的T細胞,改良TCR以增強其辨識特定抗原的能力。TCR-T利用TCR來辨識第一類主組織相容性複合物(Major Histocompatibility Complex class I, MHC I)所呈現的腫瘤抗原,這些腫瘤抗原通常不直接表現在腫瘤細胞表面,但會在分解後和MHC分子一同呈現在細胞表面並被TCR辨認。TCR-T和CAR-T的原理類似,都是強化T細胞對腫瘤細胞的免疫毒殺能力,最大的差異主要在於TCR是T細胞原本即具備的分子,可以辨識在細胞內部經分解再呈現出來的腫瘤抗原,具有比CAR-T更廣的辨識能力,亦克服了CAR-T於實體腫瘤的限制(表3)。
表3 CAR-T療法及TCR-T療法之比較
| 項目 |
CAR-T |
TCR-T |
| 結構 |
於T細胞表現合成的CAR,包括細胞外和細胞內結構 |
T細胞原有的T細胞受器,經過基因工程優化 |
| 標靶 |
針對腫瘤細胞表面抗原 |
針對MHC所呈現的細胞內或細胞表面抗原 |
| 優勢 |
|
- 可以靶向細胞內抗原,應用性更廣泛
- 於實體腫瘤呈現良好治療效果
|
| 缺點 |
|
|
| 核准上市數 |
12項 |
1項 |
資料來源:生技中心整理(2025/01)
2. 基因編輯療法帶給遺傳性罕病治療突破性進展
透過基因傳送機制的基因治療,是將正常的基因送至病人體內,以「外加」的方式提供具有正常生理功能的基因。而基因編輯療法最大的不同,在於基因編輯是透過基因或核苷酸的插入、刪除,來「修復」異常的基因序列。
1990年代CRISPR機制在大腸桿菌(E. coli)被發現,2013年被應用於哺乳細胞基因的編輯,歷經10年的開發,第一款CRISPR療法終於上市。2023年12月,Vertex和CRISPR Therapeutics合作開發的Casgevy,獲FDA核准治療SCD和輸血依賴性β地中海型貧血(Transfusion-dependent β-thalassemia, TDT),為首項獲准上市的基因編輯療法,使用CRISPR/ Cas9基因編輯技術。
鎌刀型貧血為嚴重的遺傳性血液疾病,因為基因突變造成血紅蛋白(hemoglobin, Hb,即血紅素)異常,使紅血球形成鐮刀狀,導致貧血並且有血管阻塞危機(Vaso-Occlusive Crisis, VOC)。正常情況下,BCL11A基因在出生後即會啟動,抑制胎兒血紅蛋白(Fetal hemoglobin, HbF)製造,轉而以成人血紅蛋白為主;Casgevy療法便是透過修改BCL11A基因,關閉其抑制胎兒血紅蛋白的功能,重啟胎兒血紅蛋白以替代異常的血紅蛋白。Casgevy利用CRISPR/ Cas9基因編輯技術,CRISPR做為嚮導RNA(guide RNA, gRNA)可辨識特定(需修改)的DNA序列,Cas9則為DNA剪切酶,當gRNA辨識特定DNA序列後,Cas9會將其剪斷,再重新合成正常的DNA序列。
而在Casgevy被核准的同一天,FDA也核准了Bluebird Bio公司開發的Lyfgenia,兩者同為治療SCD的基因療法。Lyfgenia是自病人收集造血幹細胞,利用病毒載體將功能正常的β球蛋白基因遞送至造血幹細胞,再將修飾過的造血幹細胞輸回病人體內。
Casgevy和Lyfgenia都屬於ex vivo基因治療,但兩者的作用機制不同(表4)。Casgevy是利用CRISPR/ Cas9編輯造血幹細胞的BCL11A基因,降低BCL11A蛋白質表現讓胎兒血紅蛋白恢復產生;Lyfgenia則是利用LV載體,在造血幹細胞外加具有功能的β球蛋白基因,增加β球蛋白的製造。此外,Lyfgenia在臨床試驗時因為有受試者死亡,因此Lyfgenia加有黑框警告,且病人治療後需長期監控。
表4 鐮刀型紅血球疾病基因治療比較
| 項目 |
Casgevy |
Lyfgenia |
| 治療流程 |
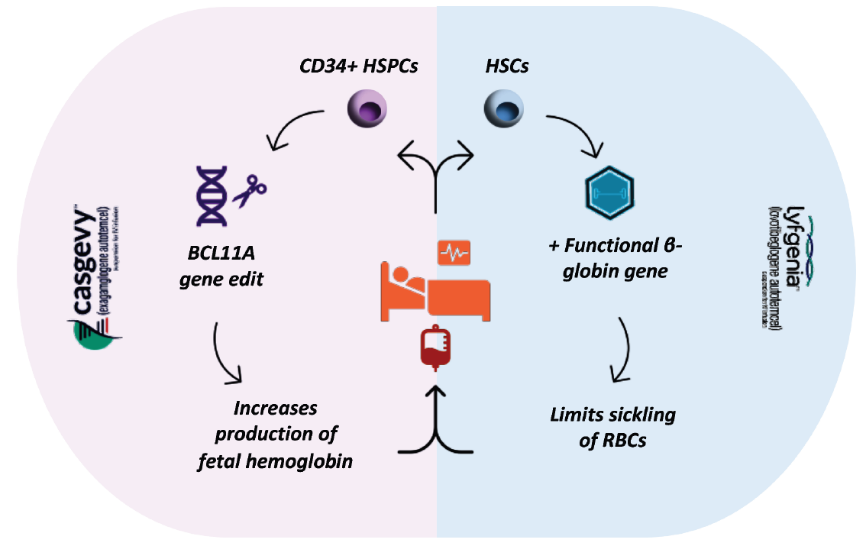 |
| 基因治療類別 |
CRISPR療法 |
基因修飾造血幹細胞 |
| 基因遞送方式 |
電穿孔 |
慢病毒載體 |
| 黑框警告 |
- |
V |
| 治療後監控 |
- |
每半年血液常規檢查(至少15年)、每2年病毒載體嵌合位點分析 |
| 特點 |
直接編輯標靶基因,但可能有脫靶的風險 |
外加具有功能性的基因 |
資料來源:A Tale of Two Company, 2024;生技中心整理(2025/01)
五、基因治療之挑戰
基因治療從研發、臨床前開發,到臨床使用,仍依循一般藥物的開發流程,但開發過程卻更為複雜。基因治療不同於小分子或抗體藥物等藥品,組成通常包括細胞、病毒載體、基因/質體(plasmid)等,造成基因治療不論是研發、生產製造或臨床應用,都有其複雜性,因此基因治療的費用動輒數十萬至數百萬美元(表5)。
表5 各項基因治療的治療頻率及費用
| 類別* |
產品名稱 |
適應症 |
治療頻率 |
藥價(美元) |
| HSC |
Libmeldy |
異染性腦白質退化症 |
一次性 |
425萬元 |
| GT |
Hemgenix |
B型血友病 |
一次性 |
350萬元 |
| GT |
Elevidys |
裘馨氏肌肉失養症 |
一次性 |
320萬元 |
| HSC |
Lyfgenia |
鐮刀型紅血球疾病 |
一次性 |
310萬元 |
| HSC |
Skysona |
腦腎上腺腦白質失養症(CALD) |
一次性 |
300萬元 |
| GT |
Roctavian |
A型血友病 |
一次性 |
290萬元 |
| HSC |
Zynteglo |
β地中海型貧血 |
一次性 |
280萬元 |
| GT |
Zolgensma |
脊髓性肌肉萎縮症(SMA) |
一次性 |
225萬元 |
| CRISPR |
Casgevy |
鐮刀型紅血球疾病、輸血依賴性β地中海型貧血 |
一次性 |
220萬元 |
| GT |
Luxturna |
遺傳性視網膜失養症(HRD) |
雙眼各1次 |
雙眼85萬元 |
| TCR-T |
Tecelra |
滑膜肉瘤 |
一次性 |
72.7萬元 |
| CAR-T |
Aucatzyl |
急性淋巴性白血病 |
一次性 |
52.5萬元 |
| CAR-T |
Kymriah |
急性淋巴性白血病 |
一次性 |
47.5萬元 |
| CAR-T |
Carvykti |
難治/復發型多發性骨髓瘤 |
一次性 |
46.5萬元 |
| CAR-T |
Abecma |
難治/復發型多發性骨髓瘤 |
一次性 |
41.95萬元 |
| CAR-T |
Breyanzi |
瀰漫性大型B細胞淋巴癌 |
一次性 |
41.03萬元 |
| CAR-T |
Kymriah |
瀰漫性大型B細胞淋巴癌 |
一次性 |
37.3萬元 |
| CAR-T |
Yescarta |
瀰漫性大型B細胞淋巴癌 |
一次性 |
37.3萬元 |
| CAR-T |
Tecartus |
套細胞淋巴癌(MCL) |
一次性 |
37.3萬元 |
| GT |
Vyjuvek |
失養性表皮分解性水皰症(DEB) |
重複外用 |
63.1萬元/年 |
| GT |
Adstiladrin |
非肌肉侵犯型膀胱癌(NMIBC) |
3個月1劑 |
24萬元/年 |
註*:HSC:基因修飾HSC;GT:病毒載體基因治療;CRISPR:CRISPR療法;TCR-T:TCR-T療法;CAR-T:CAR-T療法
註:MLD:Metachromatic leukodystrophy;CALD:cerebral adrenoleukodystrophy;SMA:Spinal Muscular Atrophy;HRD:hereditary retinal dystrophies;DEB:dystrophic epidermolysis bullosa;DMD:Duchenne muscular dystrophy;NMIBC:non-muscle invasive bladder cancer;ALL:Acute Lymphocytic Leukemia;DLBCL:Diffuse Large B-Cell Lymphoma;MCL:Mantle cell lymphoma;r/r:Refractory/Relapsed;MM:Multiple Myeloma;
資料來源:GlobalData、新聞;生技中心整理(2025.01)
藥物開發的技術大幅進步,新的技術也不斷發展,例如扮演關鍵角色的基因編輯技術、病毒載體等,使基因治療日趨多元,新型態基因治療從研發到上市的時間也越來越短,例如2023年上市的Elevidys,從第一次人體試驗到上市只花了5年的時間。而基因治療開發廠商一旦具有建置完成的技術平台及開發經驗,可以讓產品更快速上市。生產製造的複雜性是基因治療的挑戰之一,除了必需兼顧細胞以及病毒載體之外,還有其他組成如質體、蛋白質等。此外,基因治療大多是個人化醫療,在生產規範、產能之外,又增加地域性(在地化生產)的限制。重資本、高技術門檻,以及客製化生產步驟,讓許多藥廠以自建廠房(in house)以及尋求委託生產服務機構(Contract Manufacturing Organization, CMO)或委託開發暨生產服務機構(Contract Development and Manufacturing Organization, CDMO)的生產策略,來克服生產製造的挑戰。
相對於成熟的小分子或抗體藥物,基因治療仍在起步階段,僅管帶給許多以往認為無藥可醫的疾病治癒的希望,但基因治療的安全性以及療效持久性仍待長期觀察。克服基因治療開發各階段的挑戰,擴大應用性,並且降低醫療費用,將是基因治療蓬勃發展的最大目標。
(本文作者為生技中心執行產業技術基磐研究與知識服務計畫產業分析師)
12024醫藥產業年鑑,生技中心出版
2DMD為好發於男性的罕見性聯遺傳疾病,因編碼肌失養蛋白的基因發生突變,導致其失去功能無法如正常情況時保護肌肉免受損傷。DMD患者會出現肌肉萎縮、發育遲緩等症狀,甚至失去自主呼吸能力,並於30歲左右因心肺併發症而死亡。
3Gene, Cell, + RNA Therapy Landscape Report, American Society of Gene & Cell Therapy and Citeline, 2024
 點閱數
點閱數:
1134

