:::
科技新知

抗體藥物複合體發展現況
發表日期:2021-02-03
作者:鄭宇婷(生技中心)
摘要:
本文就ADC抗體藥物複合體(Antibody drug conjugates, ADC)藥品研發現況進行觀測並提出未來發展之機會及挑戰。
全文:
自1911年Paul Ehrlich提出針對微生物或腫瘤細胞定向遞送有毒物質的想法,此為抗體藥物複合體(Antibody drug conjugates, ADC)藥品的雛型概念,後續在抗體技術的進展帶領下,ADC用於治療疾病的可行性越來越高,至2010年第一個ADC產品Mylotarg上市,正式宣告ADC產品時代的來臨。ADC的設計理念為利用抗體將藥物導向細胞表面,精準地與標的細胞結合後,以高細胞毒性的小分子藥品(細胞毒殺藥物)毒殺標的細胞,此為結合抗體藥品專一性及小分子藥品毒性強之優勢進行疾病治療。本文就ADC藥品研發現況進行觀測並提出未來發展之機會及挑戰。
一、因ADC技術持續創新及改良,提升產品的安全性及療效,新產品上市,全球ADC藥品市場將快速成長
ADC藥品由三個部分所組成,分別為專一性抗體(antibody)、細胞毒殺藥物(payload)及連結子(linker),將細胞毒殺藥物透過連接子接合於專一性高的抗體形成複合體。ADC藥品利用抗體之專一性優勢,改善傳統小分子化合物非專一性作用的缺點,讓細胞毒殺物質能作用於被靶定的細胞上,兼具細胞毒殺藥物的殺傷力及抗體高專一性之特性(圖1)。
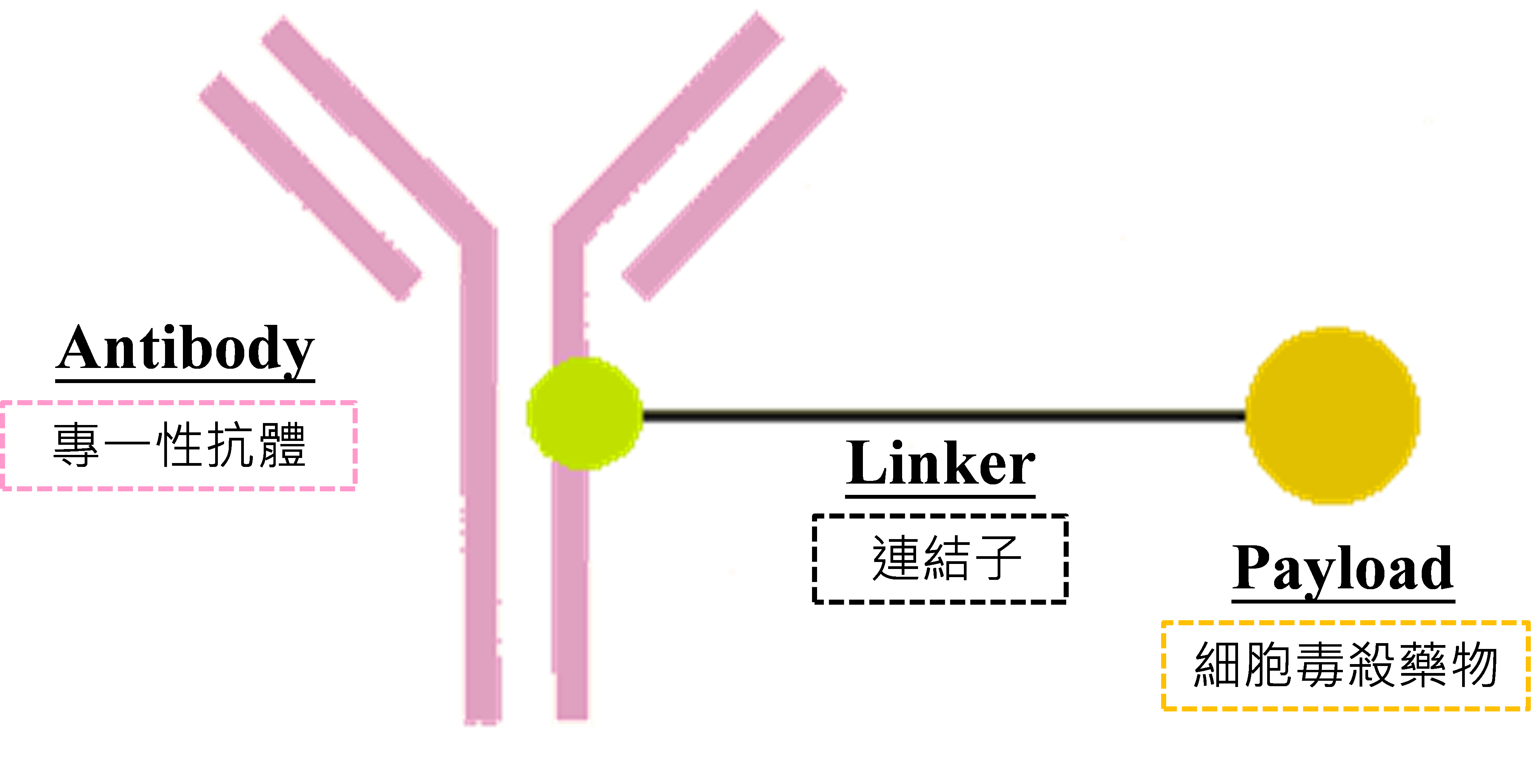
資料來源:DCB產資組ITIS研究團隊(2020.07)
圖1 ADC藥品結構圖
自2000年開始第一個ADC產品上市,截至2020年5月為止已有8款ADC產品上市,分別為2000年第一個上市的Mylotarg(2010年下市,2017年重新上市)、2010年的Adcetris、2013年的Kadcyla、2017年的Besponsa、2019年的Polivy、Padcev、Enhertu、及2020年的Trodelvy(表1)。自第一件ADC產品上市後,後續產品上市速度緩慢,但至2019年開始,在一年半之內先後有4件產品取得美國食品暨藥物管理局(Food and Drug Administration, FDA)上市許可(Polivy、Padcev、Enhertu及Trodelvy),取證速度進展飛快。
表1 已上市ADC產品列表
|
藥品名稱
|
抗體
|
抗體標的
|
美國FDA核准上市年份
|
細胞毒殺
藥物
|
目前核准之適應症
|
|
Mylotarg
|
Gemtuzumab
|
CD33
|
2011年
2017年*
|
Ozogamicin
|
急性骨髓白血病
|
|
Adcetris
|
Brentuximab
|
CD30
|
2011年
|
MMAE
|
間變性大細胞淋巴瘤、皮膚T細胞淋巴瘤、何杰金氏淋巴瘤、外周T細胞淋巴瘤、蕈狀肉芽腫
|
|
Kadcyla
|
Trastuzumab
|
HER2
|
2013年
|
DM1
|
HER2陽性乳癌
|
|
Besponsa
|
Inotuzumab
|
CD22
|
2017年
|
Ozogamicin
|
急性淋巴白血病
|
|
Polivy
|
Polatuzumab
|
CD79b
|
2019年
|
M MAE
|
復發或難治性瀰漫性大B細胞淋巴瘤
|
|
Padcev
|
Enfortumab
|
Nectin-4
|
2019年
|
MMAE
|
局部晚期或轉移性尿路上皮癌
|
|
Enhertu
|
Trastuzumab
|
HER2
|
2019年
|
Deruxtecan
|
HER2陽性乳腺癌
|
|
Trodelvy
|
Sacituzumab
|
Trop-2
|
2020年
|
Govitecan
|
轉移性三陰性乳腺癌
|
註:上巿ADC不包括抗體複合放射性物質藥物及免疫刺激物;*表Mylotarg上市年份為其兩次上市時間點
資料來源:BioMedTrack、各公司網站;DCB產資組ITIS研究團隊整理(2020.07)
在2000年產品初上市時,市場規模未達1億美元,預估未來在連接子技術的優化以降低脫靶率、抗體設計的改變以接點專一性鏈結細胞毒殺藥物、及更多種不同特性的細胞毒殺藥物,在安全性及療效被提升的情形下,將促使更多ADC產品上市。根據GlobalData及BioMedTrack的資料顯示,ADC抗體藥物2019年全球市場規模為27.0億美元,預估隨著新產品陸續核准上市,及新適應症的擴充,至2026年ADC藥品市場規模將達到177.0億美元,2020~2026年複合年成長率(Compound Annual Growth Rate, CAGR)將高達28.6%(圖2)。
資料來源:GlobalData, BioMedTrack;DCB產資組ITIS研究團隊整理(2020.07)
圖2 2011~2026年全球ADC藥品市場規模現況及預測
二、Mylotarg及Trodelvy的克服安全性及CMC的困難,捲土重來
在各上市的ADC產品的開發歷史中,以Mylotarg及Trodelvy的開發過程最為曲折,其中Mylotarg在2000年第一次上市,但在後續的臨床追蹤結果顯示,Mylotarg未能改善完全緩解率和整體存活率,且致命副作用發生的機率高,因此由Pfizer於2010年自行下市,在經由後續的研究分析後發現Mylotarg的毒性太強,原有的患者族群無法承受這樣的毒性,因此副作用及死亡率較高,在調整適用者的患者年紀及用藥頻率、劑量後,於2017年重新上市。
Trodelvy則是在2018年向美國FDA提出生物製劑藥品上市查驗登記(Biologics License Application, BLA),雖Trodelvy之治療效果優於現有藥物,卻因其化學、製造與品質管控(Chemical Manufacture and Control, CMC)資料不實的問題,在2019年1月收到美國FDA不予核准的回覆。在重新準備資料後,拖延至2020年4月才正式核准Trodelvy上市,而因CMC的問題使得上市時間受到拖延,造成公司營收上的損失。
由上述兩個案例可以發現ADC產品上市,除了療效之外,安全性及CMC是關鍵因素,而這些與患者族群的選擇和技術平台相關,因此如何篩選合適的病患族群及技術平台,是ADC產品在開發過程中需多方評估的要項。
三、研發中之ADC藥品以實體瘤治療為主,但亦開始朝向其他不同治療類別之適應症發展
分析目前已上市的ADC藥品之適應症,針對實體瘤及非實體瘤的治療用藥各占一半,但在研發階段之產品適應症,則是以實體瘤占比最高,根據Cortellis的數據顯示,目前ADC藥品八成以上用於治療實體瘤,顯示因實體瘤廣大的市場對於廠商而言極具吸引力,且因其藥物特性在毒殺目標細胞後,其毒殺效果可能同時擴及至周邊其他細胞,理論上對於實體瘤的治療更具療效,也更加吸引廠商願意投入資源開發(圖3)。
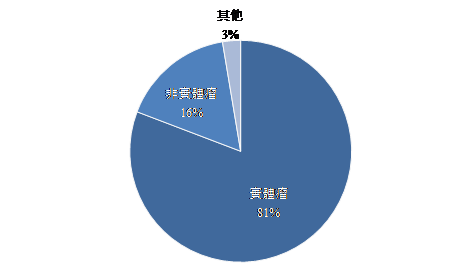
註:資料檢索時間為2020年6月30日
資料來源:Cortellis;DCB產資組ITIS研究團隊整理(2020.07)
圖3 ADC藥品各開發階段之數量統計
而一個理想的ADC產品的最重要的條件之一就是其所選擇之抗體為高專一性,且其作用標的在正常細胞上無表現或表現量少,而這樣的選擇條件亦可從目前臨床中的ADC產品觀察到。細分ADC藥品臨床試驗中實體瘤之適應症,以乳癌件數最多,歸因於抗體作用標的Her2在乳癌的療效已被確認,且專一表現於乳癌細胞上,因此以此適應症及作用標的所開發之ADC藥品件數最多。此外,除了癌症,ADC技術平台應用其他適應症之藥品開發,包括自體免疫疾病、抗感染等,如Xenikos公司開發的T-Guard,目前進度為臨床III期,適應症為急性移植物抗宿主病,靶定於免疫細胞並加以毒殺,用於治療免疫功能異常之相關疾病。
四、未來展望
不論是小分子藥品還是抗體藥品,目前皆有龐大的未滿足醫療需求,而其中很重要的一點就是這兩類藥品特性各有其優缺點,而ADC藥品則是結合小分子藥品及抗體藥品之優點,彼此互補。ADC是一種高專一性且高細胞毒殺效果的藥品,能夠在降低副作用的同時毒殺被靶定的細胞,因此對於治療癌症來說,能夠滿足強大的醫療需求,而由目前的已上市藥品可發現該技術平台的治療效果已被認可,且相關開發技術漸趨成熟,產品上市速度趨快。而觀察研發中之ADC藥品,現仍以癌症治療為主,但是相關的治療概念已擴及至自體免疫等相關疾病,在可預見的未來ADC技術平台的應用將越來越廣。
臺灣生物藥品廠商亦觀察到ADC藥品的發展潛力,進而布局ADC藥品,如浩鼎於2017年取得Abzena的ADC位點特異性製程技術,用於開發胰臟癌治療藥品OBI-999,該項產品之作用標靶為Global-H,現已於2019年在美國進入臨床I期試驗。晟德集團在中國大陸的轉投資公司東曜藥業則是自主研發乳癌治療藥品TAA013,其抗體標靶Her2,目前在中國大陸進行臨床III期試驗。
由目前的上市藥品發展來看,ADC藥品的開發中,確保用藥安全性及CMC將是成功的關鍵因素之一。因此,國內廠商在開發ADC藥品時應關注未來商業化的焦點在於如何挑選合適的病患族群,及維持產品CMC的穩定。由國外廠商開發ADC藥品之經驗,已有廠商透過精準醫療的方式,挑選合適的病患族群,另在CMC的部分,亦有廠商藉由新穎的技術平台,如專一性連結(即位點特異性(Site-Specific))的方式使抗體上所接的細胞毒殺藥品數量一致,除了降低生產過程中純化的困難之外,在臨床使用時能夠確實掌握產品在體內的代謝及藥效,有助於產品開發,對於推動產品上市亦有一定的助力。
(本文作者為生技中心執行產業技術基磐研究與知識服務計畫產業分析師)
 點閱數
點閱數:
2109

