:::
產業技術評析

2023年細胞及基因治療產業回顧
發表日期:2024-03-27
作者:王意婷(生技中心)
摘要:
隨著細胞及基因治療產品廣泛被患者使用,滿足許多未被滿足的醫療需求,在創新產品逆轉或治療疾病下,改變許多患者的生活。
全文:
隨著細胞及基因治療產品廣泛被患者使用,滿足許多未被滿足的醫療需求,在創新產品逆轉或治療疾病下,改變許多患者的生活。2023年遠離疫情影響之際,細胞及基因治療產業發展大有斬獲,共有9項全新上市的細胞及基因產品於美國、歐盟及日本等國家上市。其中美國食品暨藥物管理局(Food and Drug Administration, FDA)在政府支持產業創新發展下,總共核准7項細胞及基因治療產品,包含全球首款鐮狀細胞貧血症(Sickle Cell Disease, SCD)治療用基因藥物Casgevy和Lyfgenia之核准上市,這對細胞及基因治療產業而言無疑是迅速發展的一年。
在各國政府放寬及制定新的再生醫療相關政策及法規下,帶動廠商加碼投入細胞及基因治療產業鏈,在此同時順應精準醫療及工業4.0的發展,廠商結合數位科技如人工智慧與大數據分析與數位化應用廠商跨域推動細胞製劑自動化生產製程,加速全球細胞及基因治療產業向上發展。
一、罕見疾病與實體腫瘤治療為細胞及基因治療產品發展方向
為能治療逐年增加癌症病患及醫療迫切需求者,近幾年細胞及基因治療公司無不在找尋合適的產品進行開發,2023年共有1項自體細胞產品、3項異體細胞產品及5項基因治療產品等9項全新細胞及基因產品於美國、歐盟及日本首次上市,美國核准上市的數量最多,包含外用塗抹式可重複給藥的基因治療產品及第一個CRISPR基因編輯產品,共核准的7項細胞及基因治療產品,包含2項異體細胞產品及5項基因治療產品。2項異體細胞產品分別為Gamida Cell開發的Omisirge,以加速回復接受臍帶血幹細胞移植治療後的血癌患者體內的嗜中性球,降低感染風險及由CellTrans開發的全球首款第一型糖尿病細胞療法Lantidra;5項基因治療產品分別為Krystal Biotech針對遺傳性失養性表皮分解性水皰症之可重複給藥的外用基因療法Vyjuvek、Sarepta Therapeutics治療杜氏肌肉營養不良症的重組基因療法Elevidys、BioMarin Pharmaceutica治療嚴重A型血友病患者的基因療法Roctavian及Vertex Pharmaceuticals和CRISPR Therapeutic與Bluebird Bio開發的SCD治療用基因藥物Casgevy和Lyfgenia。這些創新產品上市意味著細胞及基因治療領域多樣化,正在逐步填補未滿足的醫療需求,改善患者的生活。
在多樣產品上市、多元治療需求及藥品保險給付等多重挹注下,2023年全球細胞及基因治療市場為181.2億美元,預估至2028年將快速擴增至412.1億美元。全球從事細胞及基因治療相關產業的廠商家數超過2,550家,北美地區因政府政策支持及擁有創新研發的研究單位,因此成為廠商主要發展的地區,超過1,000家廠商設於此地區,其次是亞太地區861家。
全球細胞及基因治療廠商於2023年執行約1,800件臨床試驗案,依產品類別劃分,以細胞修飾及腫瘤免疫細胞治療臨床試驗件數最多,超過780件,約占整體臨床試驗案的42.8%,基因治療臨床試驗件數次之,約占三成;依臨床試驗期程劃分,以臨床試驗II期件數最多,超過五成臨床試驗案於該階段(圖1)。
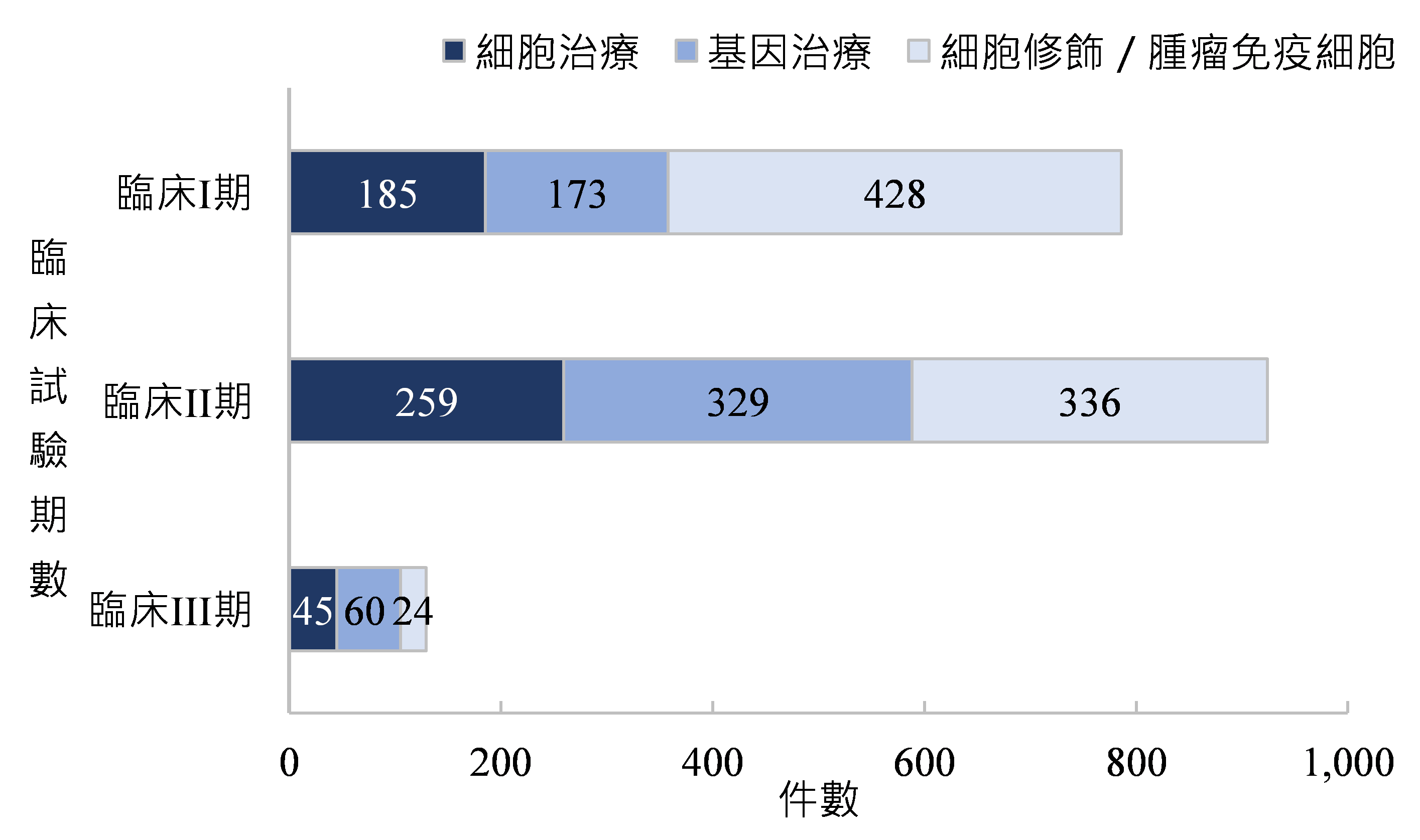
資料來源:Alliance for Regenerative Medicine;DCB產資組ITIS研究團隊(2024/01)
圖1 2023年全球細胞及基因治療臨床試驗件數分布-依臨床試驗期程
細胞及基因治療臨床試驗以腫瘤治療案件數為大宗,為解決未被滿足的醫療需求,近幾年廠商及學研單位對於實體腫瘤相關治療領域投入大量研究,2021年實體腫瘤臨床試驗件數約占腫瘤治療中之45%,而2023年實體腫瘤臨床試驗件數超過液體腫瘤件數,超過整體腫瘤治療臨床試驗案的五成,以臨床I期試驗案數最多,達322件(圖2)。
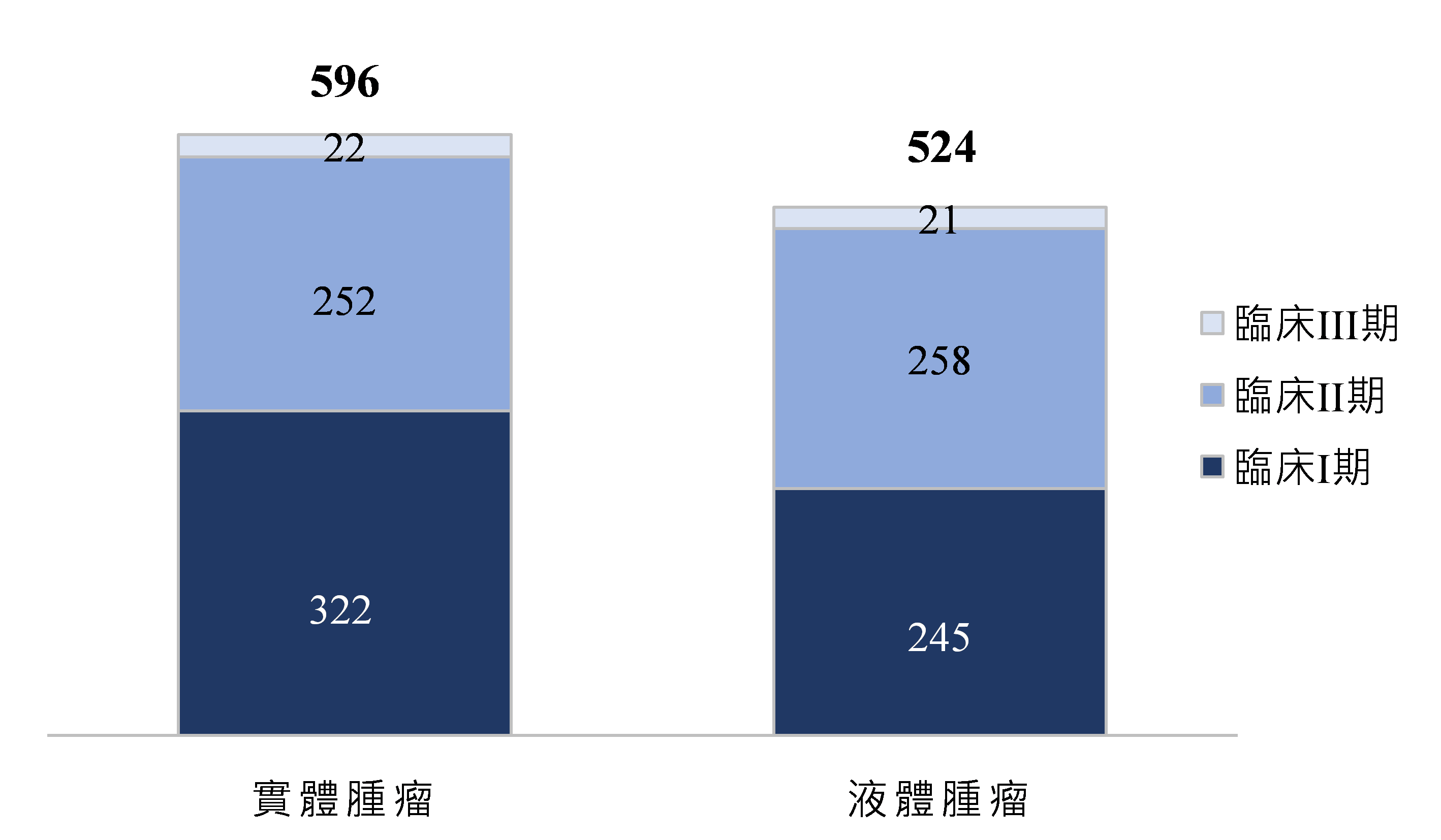
資料來源:Alliance for Regenerative Medicine;DCB產資組ITIS研究團隊(2024/01)
圖2 2023年全球細胞及基因治療臨床試驗件數分布-依適應症為腫瘤治療之腫瘤型態
全球已知的人類遺傳性疾病超過1萬多種,其中大多數為罕見疾病,罕見疾病雖然受眾少,但存在高度未被滿足的醫療需求,為數不少的廠商為此關注包含鐮刀型紅血球病、血友病、眼睛病變、代謝性疾病等罕見疾病治療,從2023年臨床試驗治療類別可以看出,包含罕見的癌症、遺傳性疾病等之罕見疾病的細胞及基因治療臨床試驗案件數遠遠超出實體腫瘤臨床試驗數量,超過740件罕見疾病臨床試驗案件正在進行中(圖3)。
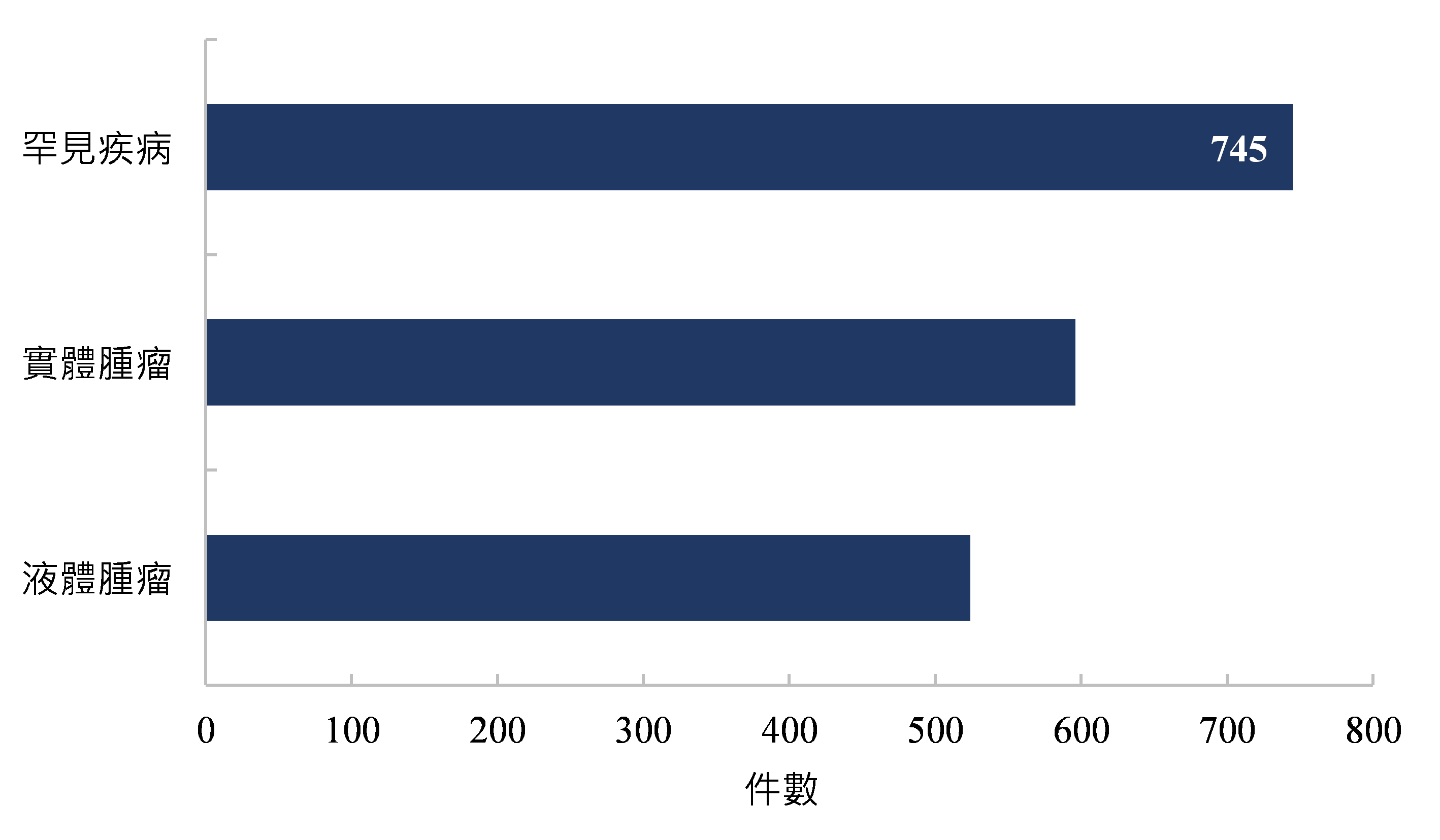
資料來源:Alliance for Regenerative Medicine;DCB產資組ITIS研究團隊(2024/01)
圖3 2023年全球細胞及基因治療臨床試驗件數分布-依適應症類別
同時,面對高齡化社會來臨,廠商也針對濕性老年黃斑部病變、視網膜色素變性和糖尿病視網膜病變等常見的眼部疾病和糖尿病併發症,提供以基因治療作為解方,如Regenxbio治療濕性老年黃斑部病變及視網膜色素變性的ABBV-RGX-314與Helixmith治療糖尿病足潰瘍的ENGENSIS目前也進展到臨床試驗III期階段。
二、臺灣相關法規與時俱進,加速細胞及基因治療產業發展
回顧臺灣細胞及基因治療產業,衛生福利部(簡稱衛福部)為對細胞及基因治療產業有所規範,陸續公告《人體細胞組織優良操作規範》、《人體細胞治療產品臨床試驗申請與審查基準》等相關法規,且於2018年9月公告《特定醫療技術檢查檢驗醫療儀器施行或使用管理辦法》(簡稱《特管辦法》),為繼日本之後二個開啟再生醫療雙軌制管理的國家。
為使細胞及基因治療管理制度與國際主要國家接軌,經過不斷修正,行政院於2023年2月將包括《再生醫療法》及《再生醫療製劑條例》的「再生醫療雙法」草案送至立法院審議,除了對執行再生醫療技術的業者、醫院、實驗室等執行單位制定相關管理規範,以確保再生醫療技術施作之品質、安全及效果外,《再生醫療製劑管理條例》更是為能使危及生命或嚴重失能患者可即早使用再生醫療製劑,對於治療上述疾病的再生醫療製劑,在完成臨床II期試驗,並經風險效益評估後具安全性及初步療效下,給予不超過5年之「暫時性許可」。我國政府在細胞及基因治療相關法規制定方向已朝向國際法規規範,希能藉由訂立相關規範讓廠商得以遵循、讓患者有藥可醫及為產業發展奠定基礎。
其中自《特管辦法》實施以來,經過多年調整與修正,現階段總共核准包含自體免疫細胞、脂肪幹細胞及纖維母細胞等53項適應症項目,截至2023年12月底止超過70家醫療院所及20家細胞治療公司共提出502件申請案,核准258件細胞治療技術(扣除已終止項目),總收案人數達1,398人(表1),現階段執行超過10件以上細胞治療計畫為包含長聖、長春藤、訊聯、鑫品、三顧等公司;經統計,核准之案件多為雙北之醫療院所,包含臺北市65件、新北市33件,合作的醫療院所達28家,包含多家專科醫院及診所。
表1 細胞治療施行計畫申請案件、核准案件及總收案人數統計
| 項目 |
申請案件數 |
核准案件數 |
總收案人數 |
| 自體免疫細胞治療 |
301 |
173 |
1,138 |
| 自體脂肪幹細胞治療 |
118 |
56 |
110 |
| 自體骨髓間質幹細胞治療 |
32 |
12 |
82 |
| 自體軟骨細胞治療 |
12 |
10 |
60 |
| 自體纖維母細胞治療 |
16 |
7 |
8 |
| 自體CD 34+ selection |
0 |
0 |
0 |
| 非附表所列細胞治療技術 |
23 |
0 |
0 |
| 總計 |
502 |
258 |
1,398 |
註:申請案件數、總收案人數統計及核准案件數統計至2023年12月底
資料來源:衛福部醫事司;DCB產資組ITIS研究團隊(2024/01)
在廠商爭相投入細胞及基因治療領域下,除了有258件細胞治療施行計畫外,衛福部食品藥物管理署(Taiwan Food and Drug Administration, TFDA)已核准3件細胞及基因治療產品上市,分別為Novartis的嵌合抗原受體T細胞(Chimeric Antigen Receptor T cell, CAR-T)CAR-T細胞治療產品Kymriah、基因治療產品Zolgensma及Luxturna;儘管我國廠商未有細胞及基因治療產品上市,但由TFDA核准執行的細胞及基因治療臨床試驗案經統計至2023年8月底共有132件,其中近半數臨床試驗案為我國廠商自行開展或與教學醫院合作的案件,目前有3件產品達到臨床III期試驗階段,廠商發展的適應症領域以肝癌、肺癌等國人好發的腫瘤治療占多數。
隨著國內細胞及基因治療技術精進與配套之再生療法規逐步完善,廠商除自行細胞製劑生產製造外,亦有委託從事細胞製劑透過生產服務(Contract Manufacturing Organization, CMO)及研究開發暨生產服務(Contract Development and Manufacturing Organization, CDMO)公司協助相關製劑生產,產業價值鏈儼然形成,臺灣擁有國內自主開發上市之細胞及基因治療產品,將指日可待。
三、結語
細胞及基因治療產業所涵蓋的新興醫療技術及產品,被視為可滿足未被滿足的醫療需求的治療解方,在個人化精準醫療驅動下,超過1,800項臨床試驗於全球各地開展中。廠商不斷在實體腫瘤及罕見疾病之治療技術上不斷精進,隨著AI與數位科技發展,廠商跨域合作,以AI、機器學習等方式尋找最適標的進行疾病精準治療或透過導入智慧自動化細胞生產設備生產質優、穩定供貨的產品,達到有效性、安全性及即時提供治療的目標。
反觀臺灣細胞及基因治療產業隨著國際技術不斷創新,我國廠商在多年發展及政策法規支持下,透過與國內外廠商、機構技術合作,精進各項細胞治療技術及導入智慧自動化生產技術,發展如γδ- T細胞或雙特異性抗體等新穎細胞/基因治療技術及產品及提供利自動化細胞製劑CDMO服務。我國累計迄至今有超過130項創新細胞及基因治療產品於臨床試驗階段,在廠商已具備開發及生產能力下,政府如能加速「再生醫療雙法」公告實施,應可加快異體細胞及基因治療產品上市時程,完善細胞及基因治療產業生態系,促進臺灣細胞及基因治療產業發展,推升產業之國際競爭力。
(本文作者為生技中心執行產業技術基磐研究與知識服務計畫產業分析師)
 點閱數
點閱數:
85

