:::
科技新知

循環腫瘤細胞分離技術發展現況與市場分析
發表日期:2017-08-23
作者:蔡孟男(工研院IEK)
摘要:
由於次世代基因定序的快速發展,成本大幅下降,使得整體液態切片市場規模也隨之快速成長。另因各式的循環腫瘤細胞分離技術獲得驗證,也朝向商品化發展,且利用商品化系統分析的臨床文獻也快速累積,讓循環腫瘤細胞的檢測發展成為液態切片市場的要角。
全文:
一、前言
由於次世代基因定序的快速發展,成本大幅下降,使得液態切片(liquid biopsy)檢測應用快速發展,包含循環去氧核醣核酸(circulating cell free DNA,cfDNA)與循環腫瘤細胞(circulating tumor cells,CTCs),以及外泌體(exosome)的研究與技術,使得整體液態切片市場規模也隨之快速成長。而目前雖然cfDNA仍為液態切片市場的主流,但循環腫瘤細胞檢測市場的成長速度也不容忽視,主要乃因各式的循環腫瘤細胞分離技術獲得驗證,也朝向商品化發展,且利用商品化系統分析的臨床文獻也快速累積,讓循環腫瘤細胞的檢測發展成為液態切片市場的要角。
二、全球液態切片市場快速成長
根據BCC Research的資料顯示,2016年全球液態切片市場規模約為19.7億美元,包含cfDNA檢測的市場規模約16.9億美元,CTCs檢測之市場規模約2.7億美元,以及尚處早期發展的外泌體檢測市場規模約1,610萬美元。目前主流檢測應用是以cfDNA為主,2016年占整體市場的85.4%,預估2020年可達到37.8億美元,年複合成長率為22.2%。而CTCs檢測的市場占比則為13.8%,預估2020年可達到6.2億美元,年複合成長率達到22.7%。因此,不論是cfDNA,或是CTCs的檢測應用市場的技術發展,都是帶動液態切片市場快速成長的重要技術。
若由應用層面分析,目前cfDNA的檢測主要應用於非侵入式產前檢查,2016年市場規模約14.3億美元,而應用於癌症檢測的市場規模則為2.2億美元,其他應用檢測則為0.4億美元;相對的,CTCs目前僅用於癌症的檢測,2016年市場規模則約為2.7億美元。由此可發現,cfDNA雖是整體液態切片檢測的主流標誌物,但以在癌症檢測應用層面,CTCs的癌症檢測應用市場也相當龐大。
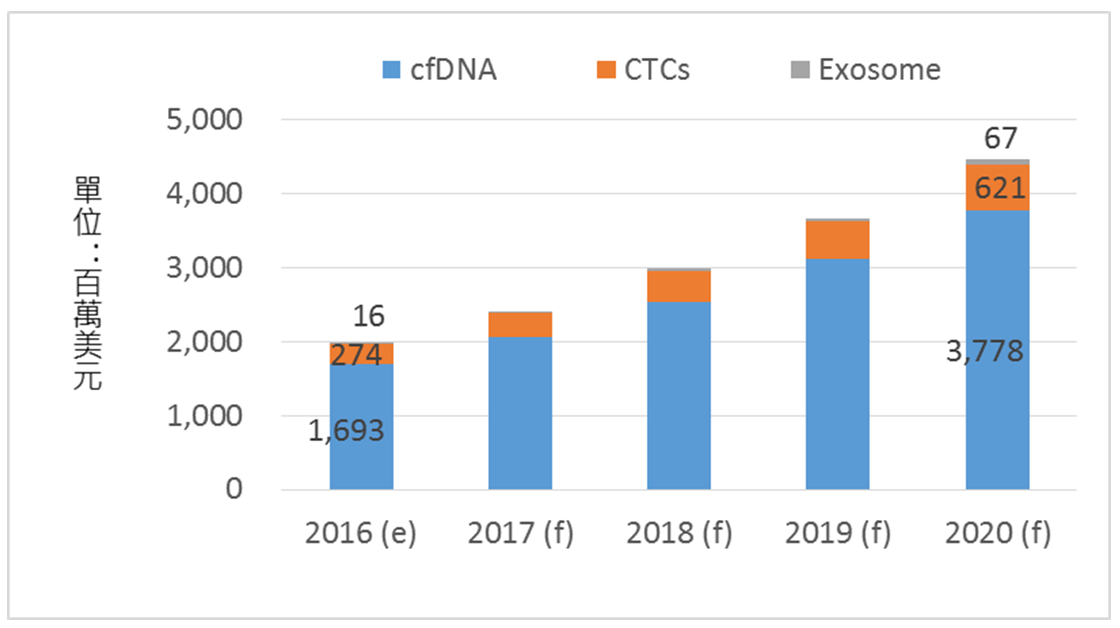
資料來源:BCC Research (2016);工研院IEK研究團隊整理(2017/08)
圖1 全球液態切片市場規模預估
三、目前循環腫瘤細胞分離技術多元,以取得活體細胞為目標
一般而言,癌症病患體內可能的循環腫瘤細胞濃度每1毫升約1~100個,然而每毫升血液中包含50億個紅血球、3億個血小板、500萬個白血球,因此要從血液樣品中分離出循環腫瘤細胞並非易事。早期的循環腫瘤細胞分離系統,受到技術與成本的限制,著重於偵測血液中循環腫瘤細胞的數目;而無法將循環腫瘤細胞分離出來,並在其仍具有細胞活性的情況下,進行變異基因、突變位點、蛋白質表達,以及染色體變異等檢測,因此在治療應用上,侷限於追蹤數目的變化。新一代的循環腫瘤細胞分離技術,受到次世代基因定序技術成熟的驅動,應用範圍不再受限於血液中循環腫瘤細胞濃度所代表的意義,而是能透過分離技術,提取個別細胞,透過各種蛋白質體或基因體學的分析,了解患者體內腫瘤發生的原因與發展的進程,作為治療策略擬定的參考依據,包含標靶藥物的選擇與成效追蹤。
目前分離CTCs的技術發展可區分為兩個主要方向,一為利用標誌物的分離方法(Label-dependent),大多使用能夠捕捉CTCs的相關抗體,並配合系統收集捕獲的CTCs。例如最早發展的CellSearch®系統,透過磁流體結合EpCAM抗體捕捉CTCs;AdnaTest®透過磁珠結合EpCAM與MUC1抗體在樣品中捕捉CTCs;Isoflux®則是以梯度離心初步分離樣品,再以微流體裝置配合EpCAM抗體分離CTCs,提升分離效率;EasySep®以負富集(negative enrichment)的策略透過CD45等抗體捕捉CTCs以外的細胞而在樣品中留下CTCs;除了體外樣品檢測外,CellCollectorTM產品則是透過抗體與靜脈留置針在體內滯留30分鐘收集CTCs。由此可見透過標誌物分離收集CTCs的技術不僅發展較早,目前也仍蓬勃發展。
另一個方法則為無標誌物的分離方法(Label-independent),多半透過細胞的物理特性分離純化CTCs。無標誌物的分離方法因純化後的CTCs由於沒有外來標誌物的干擾而更易於後續的分析而受到重視,也發展出許多產品系統,包含ISET®透過細胞大小濾篩、VitaAssayTM透過影像辨識、Vortex VTX-1透過微流體管道設計、CTC-iChip則是結合微流體與抗體負富集等方法分離純化CTCs。然而以細胞大小濾篩的技術雖然簡便快速,但分離的純度不佳,仍須配合其他純化方法;影像辨識擁有快速分離的特點,但CTCs的細胞外型差異大,因此辨識程式的準確度仍需要大量資料的累積,才能提升辨識的精準度。VTX-1則是透過CTCs與其他血球細胞的大小差異特性,單純以巧妙的微流體通道設計分離CTCs。CTC-iChip則是以微流體管道設計、抗體負富集、磁力篩選等純化策略分離CTCs。
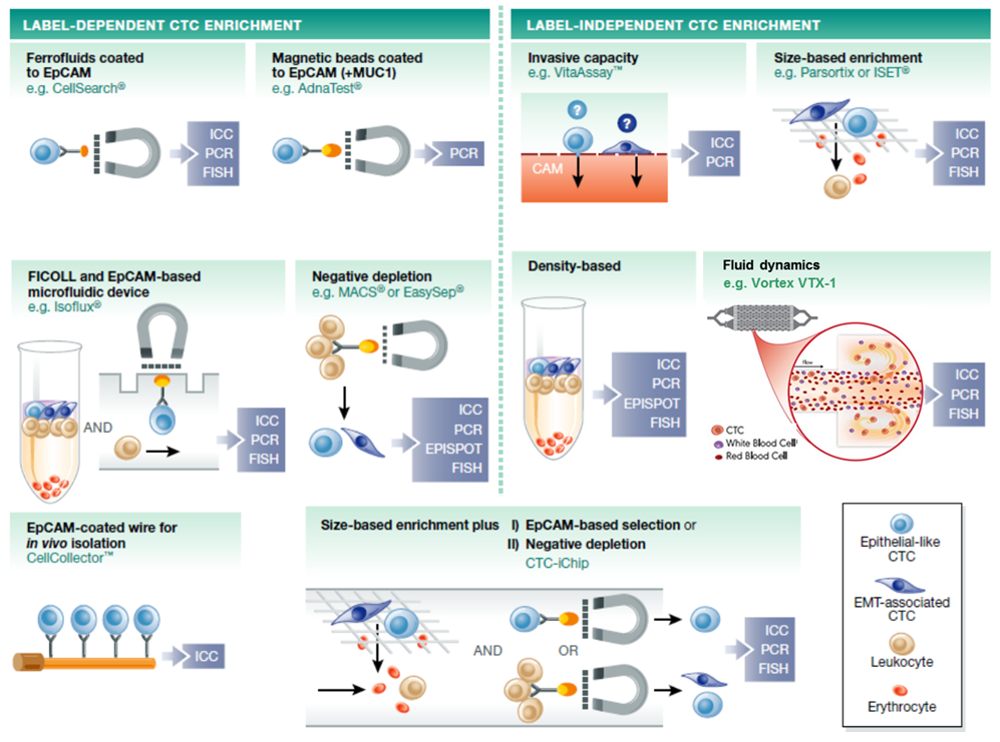
資料來源:EMBO Mol Med (2015);Nature Partner Journals: Precision Oncology (2017);工研院IEK研究團隊整理(2017/08)
圖2 循環腫瘤細胞分離技術介紹
由上述產品可知,目前新一代的循環腫瘤細胞分離設備發展多元,但仍處於早期階段,投入研發的廠商採用許多不同的技術策略提升循環腫瘤細胞的辨識率與捕獲率,雖然技術方面尚未出現統一的標準,但可以確定的是在保持細胞活性的前提下快速分離出循環腫瘤細胞,仍是新一代循環腫瘤細胞分離技術的主要發展目標。
四、小結
早期的循環腫瘤細胞分離平台主要透過抗原抗體標誌物偵測細胞數目,將細胞數目的多寡應用於診斷病患或評估治療的成果。隨著基因體學、細胞生物學的快速發展,以及基因定序的成本下降,新一代的循環腫瘤細胞分離技術則聚焦於分離出仍具有活性的循環腫瘤細胞,以便進一步偵測循環腫瘤細胞的基因與蛋白質表現,用以協助癌症治療程序,包含藥物的選擇、藥效評估,甚至是藥物的開發研究。目前新一代的循環腫瘤細胞分離技術的效能大致上都優於早期的技術;然而,不論透過大小、梯度,或是免疫層析;每經過一次分離,樣品內的細胞就會耗損,讓原本就稀少的循環腫瘤細胞更難被捕獲。由此可知,分離時間、自動化程序,仍是維持細胞的活性的技術發展關鍵要素,因此除了發展更有效率的微流體通道,避免過大的稀釋倍數造成的細胞耗損外;降低細胞滯留於分離系統內的時間,維持細胞分離後的活性;以及提高分離系統的靈敏度,避免偽陰性問題,仍是未來技術發展的關鍵。
開發循環腫瘤細胞分離相關的技術平台系統,需累積大量的基礎研究與臨床試驗,後進廠商的進入門檻高;目前新一代產品仍未形成標準,國外廠商的紛紛投入學術與臨床研究以累積能量。台灣廠商在微流體、影像辨識、自動化控制與細胞分離技術擁有不錯的發展基礎,也已有廠商整合光電、自動控制、影像辨識與生物技術,投入開發全自動的循環腫瘤細胞分離平台,並與國內醫療機構合作進行臨床研究,未來完成臨床驗證仍有機會競爭國際市場。
(本文作者為工研院IEK執行產業技術前瞻研究與知識服務計畫產業分析師)
 點閱數
點閱數:
4626

